
【题目】按要求完成下列填空:
(1)画出S2-结构示意图:___。
(2)某种核素质量数37,中子数20,其原子符号:___。
(3)某金属氯化物MCl240.5g中含有0.6molCl-,则M的摩尔质量为___。
(4)100mL0.25mol/LBaCl2溶液中Cl-的物质的量浓度为___;若将上述溶液稀释至500mL,Cl-的物质的量浓度为___。
【答案】![]()
![]() 64g/mol 0.5mol/L 0.1mol/L
64g/mol 0.5mol/L 0.1mol/L
【解析】
(1)硫离子的核外电子总数为18,最外层达到8电子稳定结构;
(2)该核素的质子数=质量数=中子数,元素符号左上角为质量数、左下角为质子数;
(3)根据氯离子的物质的量及化学式MCl2组成计算出MCl2的物质的量,然后结合M=![]() 计算;
计算;
(4)溶液中离子的浓度=电解质的浓度×一个分子中含有的离子数目;根据稀释前后离子的浓度不变来解答。
(1)S2-的核电荷数为16,核外电子总数为18,其离子结构示意图为![]() ;
;
(2)某种核素质量数37,中子数20,其质子数=37-20=17,为Cl元素,其原子符号为![]() ;
;
(3)某金属氯化物MCl2为40.5g,其含有0.6molCl-,则n(MCl2)=![]() n(Cl-)=0.6mol×
n(Cl-)=0.6mol×![]() =0.3mol,M(MCl2)=
=0.3mol,M(MCl2)=![]() =135g/mol,则M的相对原子量为:135-35.5×2=64,M的摩尔质量为64g/mol;
=135g/mol,则M的相对原子量为:135-35.5×2=64,M的摩尔质量为64g/mol;
(4)100ml0.25molL-1BaCl2溶液中,Cl-的物质的量浓度为c(Cl-)=2c(BaCl2)=2×0.25mol/L=0.5mol/L;令稀释后溶液中Cl-的物质的量浓度为c,则:0.5mol/L×100ml=c×500ml,解得c=0.1mol/L。


科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.22.4L气体所含的分子数一定大于11.2L气体所含的分子数
B.常温常压下, 由O3与O2组成的混合气体48g含有的原子数为3NA
C.标准状况下,33.6L 四氯化碳(CCl4)中含有的碳原子数目为1.5NA
D.常温常压下,7.1 g Cl2与足量的Fe充分反应,转移的电子数目为0.3 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一个绝热恒容密闭容器中通入CO(g)和H2O(g),一定条件下使反应CO(g)+H2O(g)![]() CO2(g)+H2(g)达到平衡,正反应速率随时间变化的曲线如图所示,由图可得出的结论正确的是
CO2(g)+H2(g)达到平衡,正反应速率随时间变化的曲线如图所示,由图可得出的结论正确的是

A. 反应物浓度:a点小于c点
B. 该反应的正反应为放热反应
C. c点达到平衡状态
D. Δt1=Δt2时,H2的产率:a~b段大于b~c段
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼(Mo)是一种难熔稀有金属,我国的钼储量居世界前列,钼及其合金在冶金、环保和航天等方面有着广泛的应用。碳酸钠作固硫剂并用氢还原辉钼矿的原理为MoS2(s)+4H2(g)+2Na2CO3(s)![]() Mo(s)+2CO(g)+4H20(g)+2Na2S(s) △H,实验测得平衡时的有关变化曲线如图所示。
Mo(s)+2CO(g)+4H20(g)+2Na2S(s) △H,实验测得平衡时的有关变化曲线如图所示。
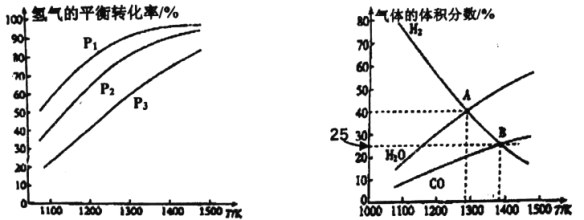
(a)不同压强下温度与H2平衡转化率的关系 (b)0.1MPa下温度与平衡时气体成分的关系
(1)由图(a)可知,该反应△H_______0(填“>”或“<”),p1、p2、p3由大到小的顺序为_______;
(2)由图(b)可知,B点时H2的平衡转化率为_______;
(3)A点对应的平衡常数K=_______(MPa)2。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用MnO2粉末与浓盐酸共热制取氯气:MnO2+4HCl![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
实验Ι验证氯气能否与水反应
某同学设计了如下图所示的实验装置:
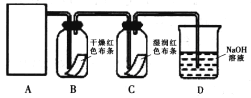
(1)从下图选择适合A处的装置__________(填序号)。
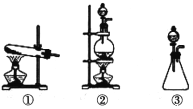
(2)装置C的实验现象 ____________________________。
(3)装置B中干燥红色布条是否褪色_________(填“是”或“否”),请说明理由____________。
(4)确定装置D的溶液中存在Cl-的试验方法是______________________________。
实验II测定反应后A中残余盐酸的浓度
步骤一:配制100mL1.00molL-1的NaOH溶液,配制过程如下:
①称量_______gNaOH固体,在烧杯中用适量蒸馏水溶解,冷却。
②将烧杯中的溶液转移至________中,并用少量蒸馏水洗涤烧杯内壁及玻璃棒2~3次,洗涤液也注入容量瓶中。
③继续加蒸馏水至离刻度线1~2cm处,改用_________滴加蒸馏水至凹槽面最低处与刻度线相切。
④盖上瓶塞,上下颠倒摇匀,将所配溶液转移至指定试剂瓶中,贴上标签。
步骤二:取2.00mL反应后A中的溶液,稀释后滴加步骤一配制所得NaOH溶液,恰好完全反应时,消耗NaOH溶液的体积为11.80mL。
(5)完成步骤一的空格。
(6)根据实验数据,计算反应后A中残余盐酸的浓度为_________molL-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据图示,回答下列问题:

(1)按要求写出下列有机物的分子结构。
乙烯的电子式__________,
乙烷的分子式________,
乙醇的结构式___________,
氯乙烷的结构简式________。
(2)写出②、④两步反应的化学方程式,并注明反应类型
②_______________________,反应类型_______________。
④_______________________,反应类型_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定某有机化合物A的结构,进行如下实验.
(1)(分子式的确定)
①将4.6 g有机物A置于氧气流中充分燃烧,实验测得:生成5.4 g H2O和8.8 g CO2,质谱仪测定该有机化合物的相对分子质量为46,则该有机物的分子式是__________;
②根据价键理论,预测A的所有可能结构并写出结构简式_____________,_____________。
(2)(结构式的确定)经测定,有机物A的核磁共振氢谱示意图如图,则A的结构简式为______________

(3)(性质实验)
① A在一定条件下脱水可生成B,B可发生加聚反应合成包装塑料C,请写出B转化为C的化学反应方程式:__________________________________________________.
②体育比赛中当运动员肌肉扭伤时,队医随即用氯乙烷(沸点为12.27℃)对受伤部位进行局部冷冻麻醉.请用B选择合适的方法制备氯乙烷,要求原子利用率为100%,请写出制备反应方程式:__________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示的一些物质或概念间的从属关系中正确的是( )
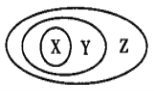
选项 | X | Y | Z |
A | 干冰 | 非电解质 | 化合物 |
B | 食盐 | 电解质 | 能导电物质 |
C | 硫酸钡 | 化合物 | 弱电解质 |
D | 纯碱 | 碱 | 电解质 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com