
【题目】向一个绝热恒容密闭容器中通入CO(g)和H2O(g),一定条件下使反应CO(g)+H2O(g)![]() CO2(g)+H2(g)达到平衡,正反应速率随时间变化的曲线如图所示,由图可得出的结论正确的是
CO2(g)+H2(g)达到平衡,正反应速率随时间变化的曲线如图所示,由图可得出的结论正确的是

A. 反应物浓度:a点小于c点
B. 该反应的正反应为放热反应
C. c点达到平衡状态
D. Δt1=Δt2时,H2的产率:a~b段大于b~c段
【答案】B
【解析】
由化学方程式可知该反应是一个反应前后气体体积不变的可逆反应,由于容器恒容,因此压强不影响反应速率,所以在本题中只考虑温度和浓度的影响,结合图象可知反应速率先增大再减小,因为只要开始反应,反应物浓度就要降低,反应速率应该降低,但此时正反应速率却是增大的,说明此时温度是影响反应的主要因素,由于容器是绝热的,因此只能是放热反应,从而导致容器内温度升高,反应速率加快。
A. a到c时反应物浓度随时间不断减小,起始时反应物浓度最大,所以反应物浓度:a点大于c点,故A错误;
B. 由上述分析可知,该反应的正反应为放热反应,故B正确;
C. 化学平衡状态的标志是各物质的浓度不再改变,其实质是正反应速率等于逆反应速率,c点对应的正反应速率显然还在改变,故c点一定未达到平衡状态,故C错误;
D. 据图可知,随着反应的进行,正反应速率增大,生成氢气的产率逐渐增大,△t1=△t2时,H2的产率:a~b段小于b~c段,故D错误,答案选B。


科目:高中化学 来源: 题型:
【题目】我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下:

则下列说法错误的是
A. 生成CH3COOH总反应是化合反应
B. ①→②过程形成了C―C键
C. CH4→CH3COOH过程中,有C―H键发生断裂
D. ①→②吸收能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A.将电能转化为化学能的装置叫电解池
B.电解时,阳离子向阴极移动,阴离子向阳极移动
C.电解池中阴极发生还原反应,阳极发生氧化反应
D.电解时,电子从电解池的阴极流出,沿导线流回电源的负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】古诗词是古人为我们留下的宝贵精神财富,下列诗句不涉及氧化还原反应的是( )
A. 粉身碎骨浑不怕,要留清白在人间
B. 野火烧不尽,春风吹又生
C. 春蚕到死丝方尽,蜡炬成灰泪始干
D. 爆竹声中一岁除,春风送暖入屠苏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种重要的含氯消毒剂。以下是过氧化氢法生产亚氯酸钠的工艺流程图:
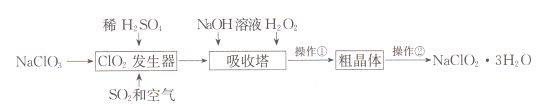
已知:①HC1O2可视为强酸,NaClO2的溶解度随温度升高而增大。②ClO2的沸点为283K,纯ClO2易分解爆炸。回答下列问题:
(1)ClO2发生器中发生反应的离子方程式为____;向其中鼓入空气的作用可能是____。
(2)吸收塔中发生反应的化学方程式为____;为防止生成的NaClO2被继续还原成NaCl,所用还原剂的还原性应适中。除H2O2外,还可以选择的还原剂是____(填序号)。
A.Na2O2 B.Na2S C. FeCl2 D.KMnO4
(3)操作①的实验方法依次是_____、_____、过滤;操作②实验方法是_____。
(4)akg NaClO3理论上可制___ kg NaClO2·3H2O。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为2L的密闭容器中发生反应xA(g)+yB(g)![]() zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示200 ℃、100 ℃下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是
zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示200 ℃、100 ℃下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是
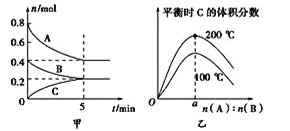
A. 200℃时,反应从开始到平衡的平均速率v(B)=0.04mol·L-1·min-1
B. 若在图甲所示的平衡状态下再向体系中充入He,此时v正> v逆
C. 由图乙可知,反应xA(g)+yB(g)![]() zC(g)的ΔH<0,且a=1
zC(g)的ΔH<0,且a=1
D. 200℃时,向容器中充入2molA和1molB,达到平衡时A的体积分数小于0.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,将3molA和1molB气体通入体积为2L的密闭容器中(容积不变),发生如下反应:3A(g)+B(g) ![]() xC(g)。2min时反应达到平衡状态(温度不变),剩余了0.8molB,并测得C的浓度为0.4mol/L,请填写下列空白:
xC(g)。2min时反应达到平衡状态(温度不变),剩余了0.8molB,并测得C的浓度为0.4mol/L,请填写下列空白:
(1)x=_____________。
(2)若继续向原平衡混合物的容器中通入少量氦气(假设氦气和A、B、C都不反应)后,化学平衡(填字母)________________。
A.向正反应方向移动 B. 向逆反应方向移动 C. 不移动
(3)若向原平衡混合物的容器中再充入3 molA和1 molB,在t℃时达到新的平衡,此时B转化率___________(“变大”、“变小”或“不变”)。
(4)假如上述反应在相同温度和容器中进行,欲使反应达到平衡时C的物质的量分数与原平衡相等,起始加入三种物质的物质的量n(A)、n(B)、n(C)之间应该满足的关系式为_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁碳微电解技术是利用原电池原理处理酸性污水的一种工艺,装置如图。若上端开口关闭,可得到强还原性的H+(氢原子);若上端开口打开,并鼓入空气,可得到强氧化性的·OH(烃基自由基)。下列说法错误的是

A. 无论是否鼓入空气,负极的电极反应式均为Fe-2e-=Fe2+
B. 不鼓入空气时,正极的电极反应式为H++e-=H·
C. 鼓入空气时,每生成1mol·OH有2mol电子发生转移
D. 处理含有草酸(H2C2O4)的污水时,上端开口应打开并鼓入空气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com