
【题目】我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下:

则下列说法错误的是
A. 生成CH3COOH总反应是化合反应
B. ①→②过程形成了C―C键
C. CH4→CH3COOH过程中,有C―H键发生断裂
D. ①→②吸收能量
科目:高中化学 来源: 题型:
【题目】赤泥是铝土矿提取氧化铝过程中产生的固体废弃物,其主要成分为Fe2O3、Al2O3、CaO、TiO2、SiO2等,属于强碱性废渣。从赤泥中回收钛的工艺流程如下:
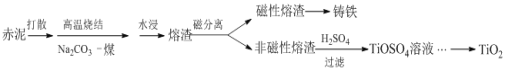
请回答以下问题:
(1)赤泥颗粒孔隙大,具有较大的比表面积,可作为废气SO2的吸收剂,研究表明该过程中主要利用了化学中和反应,其次是______。
(2)赤泥加一定量水打散的目的是______。
(3)已知高温烧结时,TiO2发生的反应是Na2CO3+TiO2 ![]() Na2TiO3+CO2↑,且Na2TiO3不溶于水。则Al2O3在烧结中发生的反应是______,水浸液里的主要溶质有______。
Na2TiO3+CO2↑,且Na2TiO3不溶于水。则Al2O3在烧结中发生的反应是______,水浸液里的主要溶质有______。
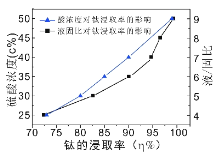
(4)酸浸时,若使钛的浸出率(η%)达到90%,则根据右图工业上应采取的适宜条件是:酸浓度和液固比的取值分别约为______、______。同时浸出温度过高可能造成的环境污染是__________。
(5)TiO2在一定条件下可转化为TiCl4而获得精制提纯,控制TiCl4水解的条件还可以制得TiO2·xH2O纳米材料,该水解过程的化学方程式是______。
(6)赤泥中含钛(以TiO2的质量分数表示)一般为4% ~12%,假设在上述工艺中钛的总回收率为75%,则1t赤泥获得TiO2的最大质量为______kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某草酸二酯结构简式如图,下列说法正确的是
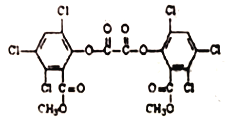
A. 草酸二酯的分子式为C26H22Cl6O8
B. 1mol草酸二酯与氢氧化钠稀溶液反应时(苯环上卤素不水解),最多消耗4molNaOH
C. 草酸二酯能发生的反应类型有氧化、还原、取代、加成、聚合、酯化
D. 草酸二酯酸性条件下充分水解可以得到三种有机物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语,说法正确的是( )
①2N ②Mg2+ ③![]() ④H2 ⑤
④H2 ⑤![]()
A. ①表示两个氮分子B. ②与⑤均表示镁离子
C. ③表示一氧化碳中碳元素的化合价为+2D. ④表示2个氢原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消細,与Cl2相比,ClO2不但具有更显著的杀菌能力,而且不会产生对人体有潜在危害的有机氯代物。制备ClO2有下列两种方法:
方法一:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
方法二:2NaClO3+H2O2+H2SO4=2ClO2↑+O2↑+Na2SO4+2H2O
(1)方法一的离子方程式为______________________________。
(2)方法二中被氧化的物质是_______,若反应中有0.1 mol电子转移,则产生的ClO2气体在标准状况下的体积为_________L。
(3)用双线桥法标出方法一中方程式电子转移的方向和数目_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱金属和卤素随着原子序数的增大,下列递变规律正确的是( )
A.碱金属单质的熔、沸点逐渐降低B.卤素单质的熔、沸点逐渐降低
C.碱金属单质的密度逐渐增大D.卤素单质的密度逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温密闭容器中发生反应:CaCO3(s)![]() CaO(s)+CO2(g) H>0,反应达到平衡后,tl时缩小容器体积, x随时间(t)变化的关系如下图所示。x不可能是
CaO(s)+CO2(g) H>0,反应达到平衡后,tl时缩小容器体积, x随时间(t)变化的关系如下图所示。x不可能是

A. υ逆(逆反应速率) B. ρ(容器内气体密度)
C. m(容器内CaO质量) D. Qc(浓度商)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一个绝热恒容密闭容器中通入CO(g)和H2O(g),一定条件下使反应CO(g)+H2O(g)![]() CO2(g)+H2(g)达到平衡,正反应速率随时间变化的曲线如图所示,由图可得出的结论正确的是
CO2(g)+H2(g)达到平衡,正反应速率随时间变化的曲线如图所示,由图可得出的结论正确的是

A. 反应物浓度:a点小于c点
B. 该反应的正反应为放热反应
C. c点达到平衡状态
D. Δt1=Δt2时,H2的产率:a~b段大于b~c段
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】众所周知H2S、SO2、NO和CO都是常见的大气污染物。
(1)下列关于H2S和SO2的说法正确的是______
A.两气体都可用浓硫酸干燥
B.两气体均可以用NaOH溶液吸收
C.可用溴水或酸性KMnO4溶液鉴别两气体
(2)目前治理汽车尾气是在催化剂条件下发生反应2NO+2CO![]() N2+2CO2,现在实验室模拟上述反应,已知t℃时在2L恒容密闭容器中加入2 molNO和1mol CO气体,经l0min达到平衡,测得此时CO2的体积分数为1/7,回答下列问题:
N2+2CO2,现在实验室模拟上述反应,已知t℃时在2L恒容密闭容器中加入2 molNO和1mol CO气体,经l0min达到平衡,测得此时CO2的体积分数为1/7,回答下列问题:
①这段时间内用CO表示的化学反应速率为_________________ 。
②该反应平衡常数为______________(保留两位有效数字)。
③平衡后再向密闭容器通入0.4molCO和0.4molCO2,平衡将_____________(填“正向”、“逆向”或“不”)移动。判断理由是_____________。
④若升温发现体系气体平均相对分子质量增大,则该反应的△H______0(填“>”、“<”或“=”)。
⑤维持条件不变,向平衡后的容器再充入0.2molNO和0.1molCO,达到新平衡,则与原平衡相比NO的转化率____________ (填“增大”、“减小”或“不变”)。
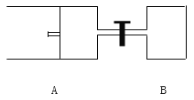
(3)如图所示,向A中充入 1mol X和1mol Y,向B中充入 2mol X和2mol Y,起始时VA=VB=aL。在相同温度和有催化剂存在的条件下,两容器各自发生下列反应:X+Y![]() 2Z+W;(四物质均为气体)。达到平衡时VA=1.2a L,试回答:
2Z+W;(四物质均为气体)。达到平衡时VA=1.2a L,试回答:
①A中X的转化率αA=______________
②A、B中X的转化率αA______αB(填“>、=、<”)。
③打开阀门,一段时间后又达到平衡时,A的体积为___ L(连通管中的气体体积不计)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com