
【题目】在恒温密闭容器中发生反应:CaCO3(s)![]() CaO(s)+CO2(g) H>0,反应达到平衡后,tl时缩小容器体积, x随时间(t)变化的关系如下图所示。x不可能是
CaO(s)+CO2(g) H>0,反应达到平衡后,tl时缩小容器体积, x随时间(t)变化的关系如下图所示。x不可能是

A. υ逆(逆反应速率) B. ρ(容器内气体密度)
C. m(容器内CaO质量) D. Qc(浓度商)
科目:高中化学 来源: 题型:
【题目】向盛有乙醇的烧杯中投入一小块金属钠,可以观察到的现象是( )
A.钠块沉在乙醇液面下面B.钠块熔成小球
C.钠块在乙醇液面上游动D.钠块表面无气泡产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼(Mo)是一种难熔稀有金属,我国的钼储量居世界前列,钼及其合金在冶金、环保和航天等方面有着广泛的应用。
(1)Mo可被发烟硝酸及氢氟酸氧化生成X和Y(少量),X和Y中Mo价态相同,硝酸本身被还原为NO2,该反应中氧化剂与还原剂的物质的量之比为6:1,则Mo在氧化产物中的化合价为___________;
(2)已知:2Mo(s)+3O2(g)===2MoO3(s) △H1;
MoS2(s)+2O2(g)===Mo(s)+2SO2(g) △H2。
写出MoS2(s)与氧气反应生成MoO3(s)的热化学方程式_____________________________;
(3)碳酸钠作固硫剂并用氢还原辉钼矿的原理为
MoS2(s)+4H2(g)+2Na2CO3(s)![]() Mo(s)+2CO (g)+4H2O(g)+2Na2S(s) △H,实验测得平衡时的有关变化曲线如图所示。
Mo(s)+2CO (g)+4H2O(g)+2Na2S(s) △H,实验测得平衡时的有关变化曲线如图所示。
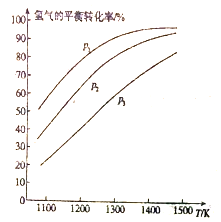
(a)不同压强下温度与H2平衡转化率的关系

(b)0.1MPa下温度与平衡时气体成分的关系
①由图(a)可知,该反应△H___________0(填“>”或“<”),p1、p2、p3由大到小的顺序为___________;
②由图(b)可知,B点时H2的平衡转化率为___________;
③A点对应的平衡常数K=___________(MPa)2。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(4)电氧化法提纯钼的原理:将辉钼矿(MoS2)放入装有食盐水的电解槽中,用惰性电极电解,MoS2被氧化为MoO42-和SO42-。
①辉钼矿应放入电解槽的___________(填“阴极区”或“阳极区”);
②阴极的电极反应式为_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下:

则下列说法错误的是
A. 生成CH3COOH总反应是化合反应
B. ①→②过程形成了C―C键
C. CH4→CH3COOH过程中,有C―H键发生断裂
D. ①→②吸收能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,已知两瓶容积相同,同温同压下,左瓶内充满氯化氢气体,当右瓶中充满下列混合气体中的某一组时,其所含原子总数与左瓶中所含原子总数一定相等,则该混合气体是( )

A. O3、N2 B. CH4、NH3 C. N2、O2 D. CO、CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A.将电能转化为化学能的装置叫电解池
B.电解时,阳离子向阴极移动,阴离子向阳极移动
C.电解池中阴极发生还原反应,阳极发生氧化反应
D.电解时,电子从电解池的阴极流出,沿导线流回电源的负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】古诗词是古人为我们留下的宝贵精神财富,下列诗句不涉及氧化还原反应的是( )
A. 粉身碎骨浑不怕,要留清白在人间
B. 野火烧不尽,春风吹又生
C. 春蚕到死丝方尽,蜡炬成灰泪始干
D. 爆竹声中一岁除,春风送暖入屠苏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为2L的密闭容器中发生反应xA(g)+yB(g)![]() zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示200 ℃、100 ℃下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是
zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示200 ℃、100 ℃下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是
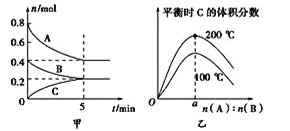
A. 200℃时,反应从开始到平衡的平均速率v(B)=0.04mol·L-1·min-1
B. 若在图甲所示的平衡状态下再向体系中充入He,此时v正> v逆
C. 由图乙可知,反应xA(g)+yB(g)![]() zC(g)的ΔH<0,且a=1
zC(g)的ΔH<0,且a=1
D. 200℃时,向容器中充入2molA和1molB,达到平衡时A的体积分数小于0.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.核素的种类比元素种类少
B.H2 、 D2 、T2 互为同位素,因为它们核内质子数相同,中子数不同
C.通常人们所说的 C—12 原子是指质子数和中子数都是 6 的碳原子
D.14 C 和12 C 互为同位素,两者的化学性质不同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com