
【题目】众所周知H2S、SO2、NO和CO都是常见的大气污染物。
(1)下列关于H2S和SO2的说法正确的是______
A.两气体都可用浓硫酸干燥
B.两气体均可以用NaOH溶液吸收
C.可用溴水或酸性KMnO4溶液鉴别两气体
(2)目前治理汽车尾气是在催化剂条件下发生反应2NO+2CO![]() N2+2CO2,现在实验室模拟上述反应,已知t℃时在2L恒容密闭容器中加入2 molNO和1mol CO气体,经l0min达到平衡,测得此时CO2的体积分数为1/7,回答下列问题:
N2+2CO2,现在实验室模拟上述反应,已知t℃时在2L恒容密闭容器中加入2 molNO和1mol CO气体,经l0min达到平衡,测得此时CO2的体积分数为1/7,回答下列问题:
①这段时间内用CO表示的化学反应速率为_________________ 。
②该反应平衡常数为______________(保留两位有效数字)。
③平衡后再向密闭容器通入0.4molCO和0.4molCO2,平衡将_____________(填“正向”、“逆向”或“不”)移动。判断理由是_____________。
④若升温发现体系气体平均相对分子质量增大,则该反应的△H______0(填“>”、“<”或“=”)。
⑤维持条件不变,向平衡后的容器再充入0.2molNO和0.1molCO,达到新平衡,则与原平衡相比NO的转化率____________ (填“增大”、“减小”或“不变”)。
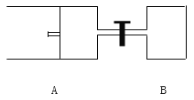
(3)如图所示,向A中充入 1mol X和1mol Y,向B中充入 2mol X和2mol Y,起始时VA=VB=aL。在相同温度和有催化剂存在的条件下,两容器各自发生下列反应:X+Y![]() 2Z+W;(四物质均为气体)。达到平衡时VA=1.2a L,试回答:
2Z+W;(四物质均为气体)。达到平衡时VA=1.2a L,试回答:
①A中X的转化率αA=______________
②A、B中X的转化率αA______αB(填“>、=、<”)。
③打开阀门,一段时间后又达到平衡时,A的体积为___ L(连通管中的气体体积不计)
【答案】B 0.02mol·L-1·min-1 0.069 逆向 通入气体后Qc大于平衡常数 > 增大 40% > 2.6a
【解析】
(1).A.H2S可以被浓硫酸氧化,不能用浓硫酸干燥,SO2与浓硫酸不反应,可以用浓硫酸干燥,故A错误;
B.两气体都能和NaOH溶液反应,被NaOH溶液吸收,故B正确;
C.两气体都能被溴水或酸性KMnO4溶液氧化,不能用溴水或酸性KMnO4溶液鉴别,故C错误,答案为:B;
(2). ①. 设10min达到平衡时NO消耗2x mol,根据平衡三段式法有:
2NO+2CO![]() N2+2CO2
N2+2CO2
起始量(mol) 2 1 0 0
转化量(mol) 2x 2x x 2x
平衡量(mol) 2-2x 1-2x x 2x,平衡时气体总物质的量为(2-2x)+(1-2x)+x+2x=(3-x)mol,则![]() =
=![]() ,解得x=0.2mol,则这段时间内用CO表示的化学反应速率为v(CO)=
,解得x=0.2mol,则这段时间内用CO表示的化学反应速率为v(CO)=![]() =
=![]() =0.02 mol·L-1·min-1,故答案为:0.02 mol·L-1·min-1;
=0.02 mol·L-1·min-1,故答案为:0.02 mol·L-1·min-1;
②. 该反应平衡常数K=![]() =
=![]() =0.069,故答案为:0.069;
=0.069,故答案为:0.069;
③.平衡后再向密闭容器通入0.4molCO和0.4molCO2,Qc=![]() =0.1>K=0.069,平衡逆向移动,故答案为:逆向;通入气体后Qc大于平衡常数;
=0.1>K=0.069,平衡逆向移动,故答案为:逆向;通入气体后Qc大于平衡常数;
④. 2NO+2CO![]() N2+2CO2的正反应为气体体积减小的可逆反应,升温发现体系气体平均相对分子质量增大,说明升高温度平衡正向移动,升高温度平衡向吸热反应方向移动,则该反应的正反应为吸热反应,△H>0,故答案为:>;
N2+2CO2的正反应为气体体积减小的可逆反应,升温发现体系气体平均相对分子质量增大,说明升高温度平衡正向移动,升高温度平衡向吸热反应方向移动,则该反应的正反应为吸热反应,△H>0,故答案为:>;
⑤. 维持条件不变,向平衡后的容器再充入0.2molNO和0.1molCO,相当于增大压强,增大压强平衡正向移动,NO的转化率增大,故答案为:增大;
(3). ①. A为恒压容器,等温等压的条件下,气体的体积之比等于气体的物质的量之比,2mol气体时体积为aL,达到平衡时VA=1.2aL,所以平衡后混合气体的物质的量为2.4mol,设X物质反应了n mol,则:
X + Y![]() 2Z + W △n
2Z + W △n
1mol 1mol
n mol (2.42)mol
解得n=0.4mol,所以X的转化率=![]() ×100%=40%,故答案为:40%;
×100%=40%,故答案为:40%;
②. B装置是在等容条件下,反应向正反应方向移动时,混合气体的物质的量增大,导致容器内气体压强增大,增大压强平衡逆向移动,X的转化率减小,所以B容器中X的转化率比A小,故答案为:>;
③.当打开阀门时,整个装置是在等温、等压条件下反应,使整个装置中气体的压强与A装置中的初始压强相同,向A中充入1molX和1molY达到平衡时,VA=1.2aL,当打开阀门时,AB中气体为3molX和3molY,由于整个装置是在等温、等压条件下的反应,达到平衡状态时,混合气体的体积应是3.6aL,其中B是aL,所以A为2.6aL,故答案为:2.6a。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下:

则下列说法错误的是
A. 生成CH3COOH总反应是化合反应
B. ①→②过程形成了C―C键
C. CH4→CH3COOH过程中,有C―H键发生断裂
D. ①→②吸收能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为2L的密闭容器中发生反应xA(g)+yB(g)![]() zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示200 ℃、100 ℃下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是
zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示200 ℃、100 ℃下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是
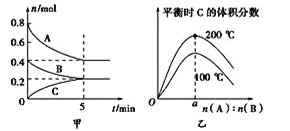
A. 200℃时,反应从开始到平衡的平均速率v(B)=0.04mol·L-1·min-1
B. 若在图甲所示的平衡状态下再向体系中充入He,此时v正> v逆
C. 由图乙可知,反应xA(g)+yB(g)![]() zC(g)的ΔH<0,且a=1
zC(g)的ΔH<0,且a=1
D. 200℃时,向容器中充入2molA和1molB,达到平衡时A的体积分数小于0.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,将3molA和1molB气体通入体积为2L的密闭容器中(容积不变),发生如下反应:3A(g)+B(g) ![]() xC(g)。2min时反应达到平衡状态(温度不变),剩余了0.8molB,并测得C的浓度为0.4mol/L,请填写下列空白:
xC(g)。2min时反应达到平衡状态(温度不变),剩余了0.8molB,并测得C的浓度为0.4mol/L,请填写下列空白:
(1)x=_____________。
(2)若继续向原平衡混合物的容器中通入少量氦气(假设氦气和A、B、C都不反应)后,化学平衡(填字母)________________。
A.向正反应方向移动 B. 向逆反应方向移动 C. 不移动
(3)若向原平衡混合物的容器中再充入3 molA和1 molB,在t℃时达到新的平衡,此时B转化率___________(“变大”、“变小”或“不变”)。
(4)假如上述反应在相同温度和容器中进行,欲使反应达到平衡时C的物质的量分数与原平衡相等,起始加入三种物质的物质的量n(A)、n(B)、n(C)之间应该满足的关系式为_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅的冶炼大致过程如下:
①富集:将方铅矿(PbS)进行浮选;
②焙烧:2PbS+3O2![]() 2PbO+2SO2 ;
2PbO+2SO2 ;
③制粗铅:PbO+C![]() Pb+CO↑;PbO+CO
Pb+CO↑;PbO+CO![]() Pb+CO2。
Pb+CO2。
下列说法错误的是
A. 浮选法富集方铅矿的过程属于物理变化
B. 将lmol PbS冶炼成Pb理论上至少需要6g碳
C. 方铅矿焙烧反应中,PbS是还原剂,还原产物只有PbO
D. 培烧过程中,每生成lmol PbO转移6mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知甲、乙、丙和X是四种中学化学中常见的物质,其转化关系如下图,则甲和X不可能是

A. 甲为C,X是O2
B. 甲为 Fe,X 为 Cl2
C. 甲为SO2,X是NaOH溶液
D. 甲为A1C13,X为NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.核素的种类比元素种类少
B.H2 、 D2 、T2 互为同位素,因为它们核内质子数相同,中子数不同
C.通常人们所说的 C—12 原子是指质子数和中子数都是 6 的碳原子
D.14 C 和12 C 互为同位素,两者的化学性质不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁碳微电解技术是利用原电池原理处理酸性污水的一种工艺,装置如图。若上端开口关闭,可得到强还原性的H+(氢原子);若上端开口打开,并鼓入空气,可得到强氧化性的·OH(烃基自由基)。下列说法错误的是

A. 无论是否鼓入空气,负极的电极反应式均为Fe-2e-=Fe2+
B. 不鼓入空气时,正极的电极反应式为H++e-=H·
C. 鼓入空气时,每生成1mol·OH有2mol电子发生转移
D. 处理含有草酸(H2C2O4)的污水时,上端开口应打开并鼓入空气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表所示的四种短周期元素 W、X、Y、Z,这四种元素的原子最外层电子数之和为 22,下列说法错误的是( )

A. X、Y 和氢三种元素形成的化合物中可能既有离子键、又有共价键
B. 物质 W3X4 中,每个原子最外层均达到 8 电子稳定结构
C. W 元素的单质是良好的半导体材料,它与 Z 元素可形成化合物 WZ4
D. X、Y、Z 三种元素最低价氢化物的沸点 HZ 最高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com