
【题目】亚氯酸钠(NaClO2)是一种重要的含氯消毒剂。以下是过氧化氢法生产亚氯酸钠的工艺流程图:
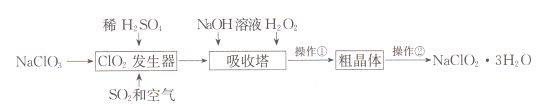
已知:①HC1O2可视为强酸,NaClO2的溶解度随温度升高而增大。②ClO2的沸点为283K,纯ClO2易分解爆炸。回答下列问题:
(1)ClO2发生器中发生反应的离子方程式为____;向其中鼓入空气的作用可能是____。
(2)吸收塔中发生反应的化学方程式为____;为防止生成的NaClO2被继续还原成NaCl,所用还原剂的还原性应适中。除H2O2外,还可以选择的还原剂是____(填序号)。
A.Na2O2 B.Na2S C. FeCl2 D.KMnO4
(3)操作①的实验方法依次是_____、_____、过滤;操作②实验方法是_____。
(4)akg NaClO3理论上可制___ kg NaClO2·3H2O。
【答案】2ClO3-+SO2=2ClO2+SO42- 稀释ClO2,防止爆炸 2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2 A 蒸发浓缩; 冷却结晶 重结晶 1.36a
【解析】
由流程可知,NaClO3溶解后与SO2发生氧化还原反应生成ClO2,结合信息②可知鼓入空气稀释ClO2,吸收塔内发生2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2,过滤后,结合信息①可知,滤液蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到NaClO23H2O。
(1)ClO2发生器中NaClO3与SO2发生氧化还原反应生成ClO2和Na2SO4,其反应的离子方程式为:2ClO3-+SO2=2ClO2+SO42-;由信息②可知,纯ClO2易分解爆炸,一般用稀有气体或空气稀释,则发生器中鼓入空气的作用应是稀释ClO2以防止爆炸,故答案为:2ClO3-+SO2=2ClO2+SO42-;稀释ClO2,防止爆炸;
(2)根据流程信息可知,吸收塔内生成NaClO2,所以一定有ClO2→NaClO2,氯元素化合价降低,ClO2被还原,则H2O2必定被氧化做还原剂,反应中有氧气产生,反应方程式为:2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2;还原性要适中,还原性太强,会将ClO2还原为更低价态产物,影响NaClO2生产;为方便后续分离提纯,加入试剂不能干扰后续生产,Na2O2溶于水相当于H2O2,Na2S、FeCl2还原性较强,而且生成物与NaClO2分离比较困难,KMnO4具有强氧化性,故答案为:2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2↑;A;
(3)从溶液中得到含结晶水的晶体,则操作①的实验方法依次是蒸发浓缩、冷却结晶,通过过滤得到粗晶体,为获得更纯净的晶体应该选择重结晶的方法,故答案为:蒸发浓缩;冷却结晶;重结晶;
(4)由氯原子个数守恒可得NaClO3~NaClO2·3H2O,则有M(NaClO3):M(NaClO2·3H2O)=
m(NaClO3):m(NaClO2·3H2O),106.5:144.5=akg:m(NaClO2·3H2O), 解得m(NaClO2·3H2O)≈1.36akg,故答案为:1.36akg。


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
【题目】下列对于硝酸的认识,不正确的是
A.浓硝酸和稀硝酸都具有氧化性B.铜与硝酸的反应属于置换反应
C.硝酸可氧化Fe2+D.可用铁或铝制品盛装浓硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱金属和卤素随着原子序数的增大,下列递变规律正确的是( )
A.碱金属单质的熔、沸点逐渐降低B.卤素单质的熔、沸点逐渐降低
C.碱金属单质的密度逐渐增大D.卤素单质的密度逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一个绝热恒容密闭容器中通入CO(g)和H2O(g),一定条件下使反应CO(g)+H2O(g)![]() CO2(g)+H2(g)达到平衡,正反应速率随时间变化的曲线如图所示,由图可得出的结论正确的是
CO2(g)+H2(g)达到平衡,正反应速率随时间变化的曲线如图所示,由图可得出的结论正确的是

A. 反应物浓度:a点小于c点
B. 该反应的正反应为放热反应
C. c点达到平衡状态
D. Δt1=Δt2时,H2的产率:a~b段大于b~c段
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子中,因发生氧化还原反应而不能大量共存的是( )
A. K+、H+、Fe2+、NO3-B. Fe3+、Ba2+、SO42-、NO3-
C. Al3+、Na+、SO42-、CO32-D. Fe3+、H+、SO42-、ClO﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将 Cl2 通入 NaBr 和 NaI 的混合液中,待反应充分后将所得的溶液加热蒸干,并灼烧,最后将得 到的固体冷却、称量.称量所得固体的质量与通入 Cl2 的体积关系如图所示.则原混合液中 NaI 的物 质的量为( )

A. 0.5 mol B. 0.4 mol C. 0.3 mol D. 0.25 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为某蛋白质的结构示意图,其中“—S—S—”为由两个“—SH”脱氢形成的二硫键,其作用是连接两个相邻肽链。若该蛋白质分子共由m个氨基酸组成,则形成一个该蛋白质分子时生成的水分子数和减少的相对分子质量分别为

A. m,18m
B. (m-4),18(m-4)
C. (m-3),18(m-3)+4
D. (m-2),18(m-2)+4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年是门捷列夫发现元素周期律150周年。下表列出了①⑧八种元素在周期表中的位置:
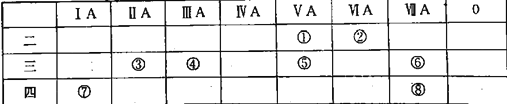
请按要求回答下列问题:
(1)写出元素②质量数为18的的核素符号_______。
(2)甲为③、⑥两元素组成的化合物,用电子式表示甲的形成过程__________。
(3)以上表中元素的最高价氧化物对应的水化物酸性最强的是_______。
(4)元素⑤的简单氢化物和元素①的简单氢化物与卤化氢的反应相似,产物的结构性质也相似。下列对元素⑤的简单氢化物与HI反应产物的推断正确的是_____(填序号)。
A.能与NaOH反应 B.含离子键、共价键 C.能与稀硫酸反应
(5)向元素⑦的单质与水反应后的溶液中加入元素④的单质,发生反应的离子反应方程式为_______。
(6)不同卤素原子之间可形成卤素互化物,其性质与卤素单质相近。写出⑥形成的互化物和SO2在水溶液中发生反应的化学方程式_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com