
【题目】将 Cl2 通入 NaBr 和 NaI 的混合液中,待反应充分后将所得的溶液加热蒸干,并灼烧,最后将得 到的固体冷却、称量.称量所得固体的质量与通入 Cl2 的体积关系如图所示.则原混合液中 NaI 的物 质的量为( )

A. 0.5 mol B. 0.4 mol C. 0.3 mol D. 0.25 mol
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】完成下列计算:
(1)0.3 mol NH3分子中所含原子数与___________个H2O分子中所含原子数相等。
(2)相同质量的SO2、SO3的氧原子的个数之比为___________。
(3)1/28 mol N2含有a个N原子,则阿伏加德罗常数可以表示为___________mol-1。
(4)4.6g Na单质变成Na+,会失去__________mol的电子
(5)已知VmL的Fe2(SO4)3溶液中含SO42- a g,取0.25VmL该溶液稀释至4VmL,则稀释后溶液中Fe3+的物质的量浓度为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属(M)﹣空气电池(如图)具有原料易得,能量密度高等优点,有望成为新能源汽车和移动设备的电源,该类电池放电的总反应方程式为:4M+nO2+2nH2O=4M(OH)n,已知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能,下列说法不正确的是( )

A. 采用多孔电极的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面
B. 比较Mg,Al,Zn三种金属﹣空气电池,Al﹣空气电池的理论比能量最高
C. M﹣空气电池放电过程的正极反应式:4M++nO2+2nH2O+4ne﹣=4M(OH)n
D. 在Mg﹣空气电池中,为防止负极区沉积Mg(OH)2,宜采用中性电解质及阳离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘元素是一种有多种化合价的非金属元素。
(1)足量的碘与56 g铁充分反应,转移的电子数为 NA;反应KIO4+8HI![]() 4I2+KI+4H2O中氧化剂与还原剂的物质的量之比为 。
4I2+KI+4H2O中氧化剂与还原剂的物质的量之比为 。
(2)在一支试管中按某顺序加入下列几种物质(一种物质只加一次):
A.KI溶液 B.淀粉溶液 C.NaOH溶液D.稀H2SO4 E.H2O2溶液
发现溶液颜色有如下变化:①无色→②棕黄色→③蓝色→④无色→⑤蓝色。则加入药品的顺序是(写序号) ,③→④反应的化学方程式为 。
(3)工业上制得的粗碘中通常含卤素互化物ICl、IBr,受热时ICl和IBr均可像I2一样升华,在粗碘中加入以下选项中的一种物质后,再进行升华可制得精碘,应加入的物质是 。
a.KBr b.KCl c.KI d.Zn
(4)有一种碘的氧化物可以称为碘酸碘,其中碘元素呈+3、+5两种价态,则这种化合物的化学式是 。
(5)医药工业的重要原料高碘酸钠可采用氯气氧化法制备。工艺流程如图:
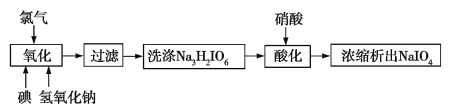
写出氧化过程中发生反应的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。 据此下列说法正确的)

A. 该试剂的物质的量浓度为 9.2 mol·L —1
B. 该硫酸 50 mL 与足量的铜反应可得到标准状况下 SO2 10.3 L
C. 配制 200 mL 4.6 mol·L —1 的稀硫酸需取该硫酸 50 mL
D. 该硫酸与等体积的水混合所得溶液的质量分数小于 49%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有较大量的Mg2+、Ag+、Ba2+ 3种阳离子,欲将3种离子逐一沉淀出来,下列加入试剂的顺序中,正确的是
①NaOH溶液、NaCl溶液、Na2SO4溶液
②NaOH溶液、Na2SO4溶液、NaCl溶液
③NaCl溶液、Na2SO4溶液、NaOH溶液
④NaCl溶液、NaOH溶液、Na2SO4溶液
A.①② B.③④ C.①③ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,有关物质的电离平衡常数如下:
化学式 | CH3COOH | H2CO3 | H2SO3 |
电离平衡常数 | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.5×10-2 K2=1.02×10-7 |
(1) CH3COOH溶液中,其电离平衡常数表达式为K =_____,常温下测得NaHSO3溶液的pH<7,其原因是_____。
(2) 常温下,将体积为10mLpH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者_____后者(填“>”、“<”或“=”)。
(3) 下列离子CH3COO-、CO32-、HSO3-、SO32-在溶液中结合H+的能力由大到小的关系为_____。
(4) 体积相同、c(H+)相同的①CH3COOH;②HCl;③H2SO4 三种酸溶液分别与同浓度的NaOH溶液完全中和时,消耗NaOH溶液的体积由大到小的排列顺序是_____(填序号)。
(5) 已知,H+(aq) + OH-(aq) == H2O(l) ΔH =-57.3 kJ/mol。实验测得稀醋酸与稀NaOH溶液反应生成1 mol H2O时放出57 kJ的热,则醋酸溶液中,醋酸电离的热化学方程式为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com