
【题目】金属(M)﹣空气电池(如图)具有原料易得,能量密度高等优点,有望成为新能源汽车和移动设备的电源,该类电池放电的总反应方程式为:4M+nO2+2nH2O=4M(OH)n,已知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能,下列说法不正确的是( )

A. 采用多孔电极的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面
B. 比较Mg,Al,Zn三种金属﹣空气电池,Al﹣空气电池的理论比能量最高
C. M﹣空气电池放电过程的正极反应式:4M++nO2+2nH2O+4ne﹣=4M(OH)n
D. 在Mg﹣空气电池中,为防止负极区沉积Mg(OH)2,宜采用中性电解质及阳离子交换膜
【答案】C
【解析】A.反应物接触面积越大,反应速率越快,所以采用多孔电极的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面,从而提高反应速率,故A正确;B.电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能,则单位质量的电极材料失去电子的物质的量越多则得到的电能越多,假设质量都是1g时,这三种金属转移电子物质的量分别为![]() ×2=
×2=![]() mol、
mol、![]() ×3=
×3=![]() mol、
mol、![]() ×2=
×2=![]() mol,所以Al-空气电池的理论比能量最高,故B正确;C.正极上氧气得电子和水反应生成OH-,因为是阴离子交换膜,所以阳离子不能进入正极区域,则正极反应式为O2+2H2O+4e-=4OH-,故C错误;D.负极上Mg失电子生成Mg2+,为防止负极区沉积Mg(OH)2,则阴极区溶液不能含有大量OH-,所以宜采用中性电解质及阳离子交换膜,故D正确;故选C。
mol,所以Al-空气电池的理论比能量最高,故B正确;C.正极上氧气得电子和水反应生成OH-,因为是阴离子交换膜,所以阳离子不能进入正极区域,则正极反应式为O2+2H2O+4e-=4OH-,故C错误;D.负极上Mg失电子生成Mg2+,为防止负极区沉积Mg(OH)2,则阴极区溶液不能含有大量OH-,所以宜采用中性电解质及阳离子交换膜,故D正确;故选C。


科目:高中化学 来源: 题型:
【题目】铜、铁、铝是重要的金属材料,铜、铁、铝及其化合物有非常重要的用途。
(1)铁元素与氯元素可形成FeCl2和FeCl3两种化合物,下列说法正确的是 (填序号)。
① 保存FeCl2溶液时,需向溶液中加入少量Fe
② FeCl2只能通过置换反应生成,FeCl3只能通过化合反应生成
③ 铜片、碳棒和FeCl3溶液组成原电池,电子由铜片沿导线流向碳棒
④ 制备AlCl3、FeCl3、CuCl2均能采用将溶液直接蒸干的方法
⑤ 含a mol AlCl3的溶液和含1.5a mol NaOH的溶液,无论正滴和反滴,生成Al(OH) 3的质量相等
(2)高铁酸钾(K2FeO4)是一种高效多功能水处理剂。K2FeO4可以铁为电极,通过电解浓的KOH溶液来制取,写出电解法制取K2FeO4的阳极反应式: 。
(3)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为3FeS2+8O2 ![]() 6SO2+Fe3O4,有3 mol FeS2参加反应,转移________ mol电子。
6SO2+Fe3O4,有3 mol FeS2参加反应,转移________ mol电子。
(4)氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式为________________;从腐蚀废液回收得到金属铜,还需要的试剂是__________________________。
(5)工业上常用铝土矿(含SiO2等杂质)生产铝。从Na2SiO3和NaAlO2混合溶液中制得Al(OH)3,需要从下列试剂中选择两种,选用的试剂组合最好是 。
a. NaOH溶液 b.氨水 c. CO2 d. 盐酸
(6)已知25 ℃时Ksp[Mg(OH)2]=5.6×1012,Ksp[Cu(OH)2]=2.2×1020,Ksp[Fe(OH)3]=4.0×1038,Ksp[Al(OH)3]=1.1×1033
①在25 ℃下,向浓度均为0.1 mol·L1的AlCl3和CuCl2混合溶液中逐滴加入氨水,先生成________沉淀(填化学式)。
②用MgCl2、AlCl3的混合溶液(A) 与过量氨水(B) 反应,为使Mg2+、Al3+同时生成沉淀,应先向沉淀反应器中加入________(填“A”或“B”),再滴加另一反应物。
③溶液中某离子物质的量浓度低于1.0×105 mol·L1时,可认为已沉淀完全。现向一定浓度的AlCl3和FeCl3的混合溶液中逐滴加入氨水,当Fe3+完全沉淀时,测定c(Al3+)=0.2 mol·L1。此时所得沉淀中________(填“还含有”或“不含有”)Al(OH)3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是部分短周期元素的原子序数与其某种常见化合价的关系图,若用原子序数代表所对应的元素,则下列说法确的是( )

A. 31d和33d属于同种核素
B. 气态氢化物的稳定性:a>d>e
C. 工业上常用电解法制备单质b和c
D. a和b形成的化合物不可能含共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知OCN-中每种元素都满足8电子稳定结构,在反应OCN-+OH-+C12→CO2+N2+C1-+H2O(未配平)中,如果有6 mol C12完全反应,则被氧化的OCN-的物质的量是
A. 2 mol B. 3 mol C. 4 mol D. 6 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将 Cl2 通入 NaBr 和 NaI 的混合液中,待反应充分后将所得的溶液加热蒸干,并灼烧,最后将得 到的固体冷却、称量.称量所得固体的质量与通入 Cl2 的体积关系如图所示.则原混合液中 NaI 的物 质的量为( )

A. 0.5 mol B. 0.4 mol C. 0.3 mol D. 0.25 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中充入等物质的量的A和B,一定温度下发生反应A(g)+xB(g)2C(g)达到平衡后,在不同的时间段,分别改变影响反应的一个条件,测得容器中各物质的物的量浓度、反应速率分别随时间的变化如图所示:下列说法中正确的是( )
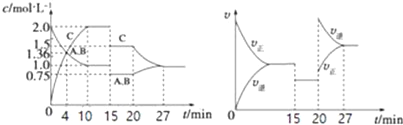
A. 4 min时反应第一次达到平衡
B. 15 min时降低压强,20 min时升高温度
C. 反应方程式中的x=1,正反应为吸热反应
D. 15~20 min该反应使用了催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学实验兴趣小组为了要探究实验室制备 Cl2 的过程中会有水蒸气和 HCl 挥发出来,同时要 证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),按要求回答问题.
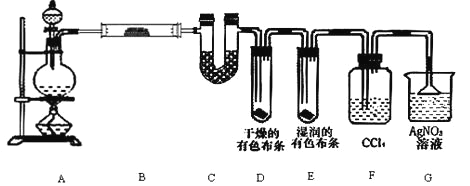
(1)若用含有 0.2mol HCl 的浓盐酸与足量的 MnO2 反应制 Cl2,制得的 Cl2 在标准状况下体积总 是________________1.12L(填“大于”或“等于”或“小于”),原因是________________。
(2)①装置 B 中盛放的试剂名称为__________,作用是________________
②装置 D 和 E 中出现的不同现象说明了________________
③装置 F 的作用是________________
④写出装置 G 中发生主要反应的离子方程式为________________.
(3)乙同学认为甲同学的实验有缺陷,不能确保最终通入 AgNO3 溶液中的气体只有一种.为了 确保实验结论的可靠性,证明最终通入 AgNO3 溶液的气体只有一种,乙同学提出在某两个装置之间 再加一个装置.你认为该装置应加在________________与________________之间(填装置字母序号),装置中应放入________________(填写试剂或用品名称).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酰氯(SO2Cl2)是一种重要的化工试剂,氯化法是合成硫酰氯(SO2Cl2)的常用方法。
实验室合成硫酰氯的实验装置如下图所示(部分夹持装置未画出):

已知:① SO2(g) + Cl2(g)=SO2Cl2(l) ΔH=-97.3 kJ/mol。
②硫酰氯常温下为无色液体,熔点为-54.1℃,沸点为69.1℃,在潮湿空气中“发烟”。
③ 100℃以上或长时间存放硫酰氯都易分解,生成二氧化硫和氯气。
回答下列问题:
(1) 装置A中发生反应的离子方程式为_________________________________。
(2) 装置B的作用为__________________________________________,若缺少装置C,装置D中SO2与Cl2还可能发生反应的化学方程式为_____________________________。
(3) 仪器D的名称为__________________,E中冷凝水的的入口是____________(填“a”或“b”),F的作用为_____________________。
(4) 当装置A中排出氯气1.12 L(已折算成标准状况)时,最终得到5.4 g纯净的硫酰氯,则硫酰氯的产率为___________。为提高本实验中硫酰氯的产率,在实验操作中需要注意的事项有________(填序号)。
① 先通冷凝水,再通气 ② 控制气流速率,宜慢不宜快
③ 若三颈烧瓶发烫,可适当降温 ④ 加热三颈烧瓶
(5) 氯磺酸(ClSO3H)加热分解,也能制得硫酰氯2ClSO3H=SO2Cl2 + H2SO4,分离产物的方法是________
A.重结晶 B.过滤 C.蒸馏 D.萃取
(6) 长期存放的硫酰氯会发黄,其原因可能为____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com