
����Ŀ��������(SO2Cl2)��һ����Ҫ�Ļ����Լ����Ȼ����Ǻϳ�������(SO2Cl2)�ij��÷�����
ʵ���Һϳ������ȵ�ʵ��װ������ͼ��ʾ(���ּг�װ��δ����)��

��֪���� SO2(g) + Cl2(g)��SO2Cl2(l) ��H����97.3 kJ/mol��
�������ȳ�����Ϊ��ɫҺ�壬�۵�Ϊ��54.1�棬�е�Ϊ69.1�棬�ڳ�ʪ�����С����̡���
�� 100�����ϻ�ʱ���������ȶ��ֽ⣬���ɶ��������������
�ش��������⣺
(1) װ��A�з�����Ӧ�����ӷ���ʽΪ_________________________________��
(2) װ��B������Ϊ__________________________________________����ȱ��װ��C��װ��D��SO2��Cl2�����ܷ�����Ӧ�Ļ�ѧ����ʽΪ_____________________________��
(3) ����D������Ϊ__________________��E������ˮ�ĵ������____________(�a����b��)��F������Ϊ_____________________��
(4) ��װ��A���ų�����1.12 L(������ɱ�״��)ʱ�����յõ�5.4 g�����������ȣ��������ȵIJ���Ϊ___________��Ϊ��߱�ʵ���������ȵIJ��ʣ���ʵ���������Ҫע���������________(�����)��
�� ��ͨ����ˮ����ͨ�� �� �����������ʣ��������˿�
�� ��������ƿ���̣����ʵ����� �� ����������ƿ
(5) �Ȼ���(ClSO3H)���ȷֽ⣬Ҳ���Ƶ�������2ClSO3H��SO2Cl2 + H2SO4���������ķ�����________
A���ؽᾧ B������ C������ D����ȡ
(6) ���ڴ�ŵ������Ȼᷢ�ƣ���ԭ�����Ϊ____________________��
���𰸡� 2MnO4- + 10Cl- + 16H+��2Mn2+ + 5Cl2��+ 8H2O ��ȥHCl SO2 + Cl2 + 2H2O��2HCl + H2SO4 ������ƿ a ����β������ֹ��Ⱦ��������ֹˮ�������� 80% �٢ڢ� C �����ȷֽ��������
����������1��װ��A�Ʊ����������з�����Ӧ�����ӷ���ʽΪ2MnO4- + 10Cl- + 16H+��2Mn2+ + 5Cl2��+ 8H2O����2�����ɵ������к����Ȼ��⣬���װ��B�б���ʳ��ˮ������Ϊ��ȥHCl����������ǿ�����ԣ�������SO2�������ȱ��װ��C��װ��D��SO2��Cl2�����ܷ�����Ӧ�Ļ�ѧ����ʽΪSO2 + Cl2 + 2H2O��2HCl + H2SO4����3���������������֪����D������Ϊ������ƿ��������ȴЧ���ã���E������ˮ�ĵ������a��������SO2������Ⱦ�����壬��F������Ϊ����β������ֹ��Ⱦ����������Ϊ�������ڳ�ʪ�������������������ͬʱ��ֹˮ�������롣��4�����������ʵ���Ϊ1.12L��22.4L/mol=0.05mol���ɷ���ʽ��֪n��SO2Cl2��=n��Cl2��=0.05mol��������������SO2Cl2������Ϊ0.05mol��135g/mol=6.75g���������Ϊ5.4g/6.75g��100%=80%��Ϊ��߱�ʵ���������ȵIJ��ʣ����Կ����������٣��������˿죬ʹ���ַ�Ӧ������100������SO2Cl2��ʼ�ֽ⣬�÷�ӦΪ���ȷ�Ӧ�����Զ�������ƿ�����ʵ��Ľ��£���ѡ�٢ڢ�����5������Ϊ����Һ�壬�е����ϴ�ȡ�����з��룬��ѡC����6��100�����ϻ�ʱ���������ȶ��ֽ⣬���ɶ������������������Ϊ����ɫ���壬�������ܽ��������¡�


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������M����������أ���ͼ������ԭ���ã������ܶȸߵ��ŵ㣬������Ϊ����Դ�������ƶ��豸�ĵ�Դ�������طŵ���ܷ�Ӧ����ʽΪ��4M+nO2+2nH2O=4M��OH��n����֪����صġ����۱�������ָ��λ�����ĵ缫�������������ͷų��������ܣ�����˵������ȷ���ǣ�������

A. ���ö�缫��Ŀ������ߵ缫��������Һ�ĽӴ��������������������ɢ���缫����
B. �Ƚ�Mg��Al��Zn���ֽ�����������أ�Al��������ص����۱��������
C. M��������طŵ���̵�������Ӧʽ��4M++nO2+2nH2O+4ne��=4M��OH��n
D. ��Mg����������У�Ϊ��ֹ����������Mg��OH��2���˲������Ե���ʼ������ӽ���Ĥ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[2016���¿α�II��]ij��ͬѧ������ʵ��̽��Fe2+��Fe3+�����ʡ��ش��������⣺
��1���ֱ�ȡһ�����Ȼ������Ȼ��������壬�����Ƴ�0.1 mol/L����Һ����FeCl2��Һ�������������м����Ŀ����__________________________��
��2������ͬѧȡ2 mL FeCl2��Һ�����뼸����ˮ���ټ���1��KSCN��Һ����Һ��죬˵��Cl2�ɽ�Fe2+������FeCl2��Һ����ˮ��Ӧ�����ӷ���ʽΪ_______________________________��
��3������ͬѧ��Ϊ�����ʵ�鲻���Ͻ�������ͬѧ��2 mL FeCl2��Һ���ȼ���0.5 mLú�ͣ�����Һ�������μ��뼸����ˮ��l��KSCN��Һ����Һ��죬ú�͵�������______��
��4������ͬѧȡ10 mL 0.1 mol/L KI��Һ������6 mL 0.1 mol/L FeCl3��Һ��ϡ��ֱ�ȡ2 mL����Һ��3 ֧�Թ��н�������ʵ�飺
����һ֧�Թ��м���1 mL CCl4��������ã�CCl4�����ɫ��
���ڶ�֧�Թ��м���1��K3[Fe(CN)6] ��Һ��������ɫ������
������֧�Թ��м���1��KSCN��Һ����Һ��졣
ʵ���������������__________�������ӷ��ţ���ʵ��������˵������I ����������£���Һ���Ժ���___________�������ӷ��ţ����ɴ˿���֤����������ԭ��ӦΪ_____________________��
��5������ͬѧ��ʢ��H2O2��Һ���Թ��м��뼸���ữ��FeCl2��Һ����Һ����ػ�ɫ��������Ӧ�����ӷ���ʽΪ_______________________________��һ��ʱ�����Һ�������ݳ��֣������ȣ�����к��ɫ�������ɡ��������ݵ�ԭ����____________________________________________�����ɳ�����ԭ����___________________________________����ƽ���ƶ�ԭ�����ͣ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ͻ����������й㷺Ӧ�á����������������Ͻ����
A. Ӳ�� B. ��ͭ C. ����� D. ˮ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����ѧ��Ѱ�Ҹ�Ч������ͨ�����·�Ӧʵ�ִ�����Ⱦ��ת����
2CO(g) +2NO(g) ![]() N2(g)+2CO2(g) ��H1
N2(g)+2CO2(g) ��H1
��֪��CO��ȼ���ȡ�H2=-283kJ/moL
N2(g) +O2(g) =2NO(g)���ֻ�ѧ���ļ����������£�
��ѧ�� | N��N�� | O=O�� | NO�е���� |
����(kJ/mol) | 945 | 498 | 630 |
���H1__________________��
��2��NH3��Ϊһ����Ҫ����ԭ�ϣ�������Ӧ���ڹ�ҵ�����������й����ʷ�Ӧ�Ĵ����о������������863�ƻ����ں��º���װ���г���һ������NH3��O2����ij�����������½���������ӦI����ò�ͬʱ���NH3��O2��Ũ�����±���
ʱ�䣨min�� | 0 | 5 | 10 | 15 | 20 | 25 |
C(NH3)/mol��L-1 | 1.00 | 0.36 | 0.12 | 0.08 | 0. 0072 | 0.0072 |
C(O2)/mol��L-1 | 2.00 | 1.20 | 0.90 | 0.85 | 0.84 | 0.84 |
�������й���������ȷ����______________
A.ʹ�ô���ʱ���ɽ��÷�Ӧ�Ļ�ܣ��ӿ��䷴Ӧ����
B. �����������4v��(NH3)=6v��(H2O)ʱ��˵����Ӧ�Ѵ�ƽ��
C.��������![]() =1ʱ��˵����Ӧ�Ѵ�ƽ��
=1ʱ��˵����Ӧ�Ѵ�ƽ��
D.ǰ10�����ڵ�ƽ������v��NO��=0.088mol��L-1��min-1
<>��3����������ʱ�ᷢ����������������ӦI��II�����������н�ǿ��ѡ���ԣ���רһ�ԡ���֪����ӦI 4NH3(g)+5O2(g)![]() 4NO(g) +6H2O(g)
4NO(g) +6H2O(g)
��Ӧ II��4NH3(g)+3O2(g) ![]() 2N2(g) +6H2O(g)
2N2(g) +6H2O(g)
Ϊ����ij�����Ը÷�Ӧ��ѡ���ԣ���1L�ܱ������г���1 mol NH3��2mol O2������й����ʵ�����ϵ��ͼ��

�ٸô����ڸ���ʱѡ��Ӧ____________ (� I ���� II������
�� 520��ʱ��4NH3(g)+3O2![]() 4N2(g) +6H2O(g)��ƽ�ⳣ��K=________________ (��Ҫ��ó���������ֻ���г����ּ���ʽ����
4N2(g) +6H2O(g)��ƽ�ⳣ��K=________________ (��Ҫ��ó���������ֻ���г����ּ���ʽ����
����ͼ����жϣ���ӦI����Ӧ��H_______________ 0���>������<������=����
��C���B����������NO�����ʵ����ٵ���Ҫԭ��_________________________��
��4���ǰ���NH2OH���ĵ���ʽ_____________���ǰ���һ�ֻ�ԭ�����������������ԭ�廯�����������ʺ͵������÷�Ӧ�Ļ�ѧ����ʽΪ______________________________��
����25.00mL0.049mol/L���ǰ���������Һ����������������Һ����������·�Ӧ�����ɵ�Fe2+ǡ����24.50mL 0.020mol/L��KMnO4������Һ��ȫ���ã�����������Ӧ�У��ǰ�������������_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ���й����ʵĵ���ƽ�ⳣ�����£�
��ѧʽ | CH3COOH | H2CO3 | H2SO3 |
����ƽ�ⳣ�� | K=1.8��10��5 | K1=4.3��10��7 K2=5.6��10��11 | K1=1.5��10��2 K2=1.02��10��7 |
(1) CH3COOH��Һ�У������ƽ�ⳣ������ʽΪK =_____�������²��NaHSO3��Һ��pH��7����ԭ����_____��
(2) �����£������Ϊ10mLpH=2�Ĵ�����Һ����������Һ�ֱ������ˮϡ����1000mL��ϡ�ͺ���Һ��pH��ǰ��_____���ߣ����������������=������
(3) ��������CH3COO����CO32����HSO3����SO32������Һ�н��H���������ɴ�С�Ĺ�ϵΪ_____��
(4) �����ͬ��c(H��)��ͬ�Ģ�CH3COOH����HCl����H2SO4 ��������Һ�ֱ���ͬŨ�ȵ�NaOH��Һ��ȫ�к�ʱ������NaOH��Һ������ɴ�С������˳����_____(�����)��
(5) ��֪��H��(aq) + OH��(aq) == H2O(l) ��H =��57.3 kJ/mol��ʵ����ϡ������ϡNaOH��Һ��Ӧ����1 mol H2Oʱ�ų�57 kJ���ȣ��������Һ�У����������Ȼ�ѧ����ʽΪ_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ʵ���;�����ʵĻ�ѧ�����йص���(����)
A. �ô����ȥˮ��
B. �ɱ������䶳��
C. ����̿������ζ��
D. ������ͷʱ����С�մ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����.��1���о������ķ���ʴ��ʩ�����ش�������ͼ��ʾװ�ÿ���ģ�����ĵ绯ѧ����������YΪNaCl��
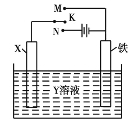
Ϊ�������ĸ�ʴ��
����XΪ̼��������KӦ���� (����ĸ)������ʱX�������ĵ缫��ӦʽΪ ��
����XΪп������K����M�������ʱ���������ĵ缫��ӦʽΪ ��
��2���ڳ����е��³������ݺύ���Ĺܵ��������·�����ϻ��������죬���е���й©�볱ʪ�������У���������ܵ��γɻ�·ʱ���ͻ�������ߵĸ�ʴ��Ϊ��ʾ��ԭ����ij�༶��ѧ������������װ��ͼ(����缫���Ͼ�Ϊ�����������Һ��ΪNaCl��Һ)��
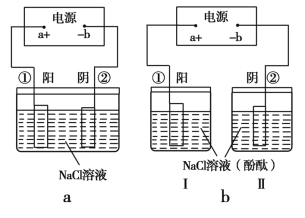
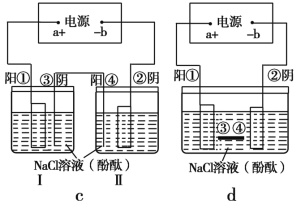
����Ϊ�����ܺ���ģ������ܵ��ĸ�ʴԭ������ ��c(��)���ܷ�Ӧ����ʽ�� ����ͼd �н�ͨ��Դ����ƽ�ŵ���˿���������������� ������Ϊ��ֹ���½����ܵ���ʴ�ṩһ�ֲ��� ��
��.1 Lij��Һ�к��е��������±���
���� | Cu2+ | Al3+ |
| Cl |
���ʵ���Ũ��/(mol/L) | 2 | 1 | 4 | x |
�ö��Ե缫������Һ������·����5 mol ����ͨ��ʱ����Һ��pH= (���Ե��ʱ��Һ����ı仯���缫������ܴ��ڵ��ܽ�����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z���ֶ�����Ԫ��ԭ���������κ�С��ԭ�Ӱ뾶�Ĵ�С��ϵΪ��r(Y)>r(X)>r(Z)�� ����Ԫ�ص�ԭ������֮��Ϊ16��X��Y��Z����Ԫ�صij����������ʵ������¿ɷ�����ͼ��ʾ�仯������B��C��Ϊ10���ӷ��ӡ�����˵������ȷ���ǣ� ��

A. XԪ��λ�ڢ�A�� B. A������B��
C. A��C�����ܷ���������ԭ��Ӧ D. B�ķе����C�ķе�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com