
【题目】合金在生活中有广泛应用。下列物质不属于合金的是
A. 硬铝 B. 青铜 C. 不锈钢 D. 水银
科目:高中化学 来源: 题型:
【题目】下图是部分短周期元素的原子序数与其某种常见化合价的关系图,若用原子序数代表所对应的元素,则下列说法确的是( )

A. 31d和33d属于同种核素
B. 气态氢化物的稳定性:a>d>e
C. 工业上常用电解法制备单质b和c
D. a和b形成的化合物不可能含共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学实验兴趣小组为了要探究实验室制备 Cl2 的过程中会有水蒸气和 HCl 挥发出来,同时要 证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),按要求回答问题.
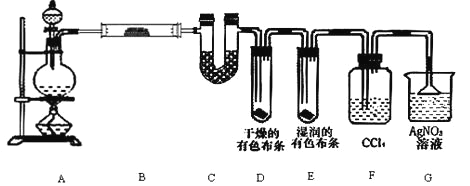
(1)若用含有 0.2mol HCl 的浓盐酸与足量的 MnO2 反应制 Cl2,制得的 Cl2 在标准状况下体积总 是________________1.12L(填“大于”或“等于”或“小于”),原因是________________。
(2)①装置 B 中盛放的试剂名称为__________,作用是________________
②装置 D 和 E 中出现的不同现象说明了________________
③装置 F 的作用是________________
④写出装置 G 中发生主要反应的离子方程式为________________.
(3)乙同学认为甲同学的实验有缺陷,不能确保最终通入 AgNO3 溶液中的气体只有一种.为了 确保实验结论的可靠性,证明最终通入 AgNO3 溶液的气体只有一种,乙同学提出在某两个装置之间 再加一个装置.你认为该装置应加在________________与________________之间(填装置字母序号),装置中应放入________________(填写试剂或用品名称).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,不正确的是( )
A.反应热指的是反应过程中放出的热量
B.中和反应都是放热反应
C.伴随着能量变化的过程不一定是化学反应
D.原电池是化学能转化成电能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大力发展电动汽车,可以有效控制空气污染。目前机动车常使用的电池有铅蓄电池、锂电池等。
I.铅蓄电池充放电的总反应为:PbO2+Pb+2H2SO4 ![]() 2PbSO4+2H2O,锂硫电池充放电的总反应为:2Li+S
2PbSO4+2H2O,锂硫电池充放电的总反应为:2Li+S![]() Li2S。
Li2S。
(1)82Pb的原子结构示意图为 。铅蓄电池的正极材料为_________。
(2)当消耗等质量的负极活性物质时,锂硫电池的理论放电量是铅蓄电池的 ____倍。(保留三位有效数字)。
(3)古代用PbSO4作油画的白色颜料,置于空气会慢慢变成黑色的PbS,从而使油画色彩变暗。用H2O2清洗可使油画“复原”。用化学方程式表示该复原的原理________。
II.由方铅矿(PbS)制备铅蓄电池电极材料(PbO2)的方法如下:
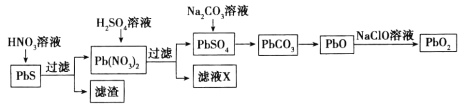
(4)滤液X是一种可循环使用的物质,其溶质主要是__________________(填化学式),若X中残留的![]() 过多,循环使用时可能出现的问题是___________________________。
过多,循环使用时可能出现的问题是___________________________。
(5)向 PbSO4中加Na2CO3溶液会发生:PbSO4 (s)+ ![]() (aq)
(aq)![]() PbCO3 (s)+
PbCO3 (s)+ ![]() (aq)。已知25℃时,Ksp(PbSO4)= 1.8×10-8,Ksp(PbCO3)=1.5×10-13。列式并计算该反应此温度下的平衡常数K 。(提示:需写出K的表达式、代入数据、算出结果)
(aq)。已知25℃时,Ksp(PbSO4)= 1.8×10-8,Ksp(PbCO3)=1.5×10-13。列式并计算该反应此温度下的平衡常数K 。(提示:需写出K的表达式、代入数据、算出结果)
(6)以石墨为电极电解Pb(NO3)2溶液也可以制得PbO2。PbO2将在 极生成(填“阴”或“阳”);而另一极的电极反应式为 ,故Pb元素的利用率较低。若在Pb(NO3)2溶液中加入适量Cu(NO3)2则可有效利用Pb2+,其理由是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可以用废铁屑制备活性Fe3O4,流程如下图:
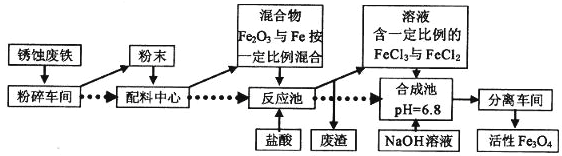
(1)在制备过程中,要将块状固体原料粉碎、磨成粉末,作用是________________________
(2)在合成池里生成Fe3O4的离子方程式为__________________________
(3)假如在反应池中几乎没有气体产生,根据流程可知,配料中心很可能使混合物中的Fe2O3与Fe物质的量之比接近________
(4)某同学利用废铁屑(含Fe和Fe2O3)来制取FeCl3·6H2O晶体,同时测定混合物中铁的质量分数,装置如图(夹持装置略,气密性已检验):

操作步骤如下:
I.打开弹簧夹K1、关闭弹簧夹K2,并打开活塞a,缓慢滴加盐酸。
Ⅱ.当……时,关闭弹簧夹K1打开弹簧夹K2,当A中溶液完全进入烧杯后关闭活塞a。
Ⅲ.将烧杯中溶液蒸发浓缩、冷却结晶、过滤后得到FeC13·6H2O晶体。
请回答:
①操作Ⅱ中“……”的内容是______________,烧杯中的现象是________________,相应的方程式是________________、________________。(是离子反应的写离子方程式)
②若混合物质量为m g,实验结束后测得B中所得的气体是V mL(标准状况时),该同学由此计算出此废铁屑中铁的质量分数是![]() ,该数值比实际数值偏低,若实验过程操作无误,偏低的原因是______________________。
,该数值比实际数值偏低,若实验过程操作无误,偏低的原因是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酰氯(SO2Cl2)是一种重要的化工试剂,氯化法是合成硫酰氯(SO2Cl2)的常用方法。
实验室合成硫酰氯的实验装置如下图所示(部分夹持装置未画出):

已知:① SO2(g) + Cl2(g)=SO2Cl2(l) ΔH=-97.3 kJ/mol。
②硫酰氯常温下为无色液体,熔点为-54.1℃,沸点为69.1℃,在潮湿空气中“发烟”。
③ 100℃以上或长时间存放硫酰氯都易分解,生成二氧化硫和氯气。
回答下列问题:
(1) 装置A中发生反应的离子方程式为_________________________________。
(2) 装置B的作用为__________________________________________,若缺少装置C,装置D中SO2与Cl2还可能发生反应的化学方程式为_____________________________。
(3) 仪器D的名称为__________________,E中冷凝水的的入口是____________(填“a”或“b”),F的作用为_____________________。
(4) 当装置A中排出氯气1.12 L(已折算成标准状况)时,最终得到5.4 g纯净的硫酰氯,则硫酰氯的产率为___________。为提高本实验中硫酰氯的产率,在实验操作中需要注意的事项有________(填序号)。
① 先通冷凝水,再通气 ② 控制气流速率,宜慢不宜快
③ 若三颈烧瓶发烫,可适当降温 ④ 加热三颈烧瓶
(5) 氯磺酸(ClSO3H)加热分解,也能制得硫酰氯2ClSO3H=SO2Cl2 + H2SO4,分离产物的方法是________
A.重结晶 B.过滤 C.蒸馏 D.萃取
(6) 长期存放的硫酰氯会发黄,其原因可能为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向l0mL0.1mol/L的HR溶液中逐渐滴入0.lmol/L的NH3·H2O 溶液,所得溶液pH及导电性变化如图。下列分析不正确的是

A. ab点导电能力增强,说明HR为弱酸
B. b点溶液,c(NH3H2O)=c(R-)+c(H+)-c(OH-)
C. c点溶液,存在c(NH4+)>c(R-)>c(OH-)>c(H+)
D. 常温下,HR和NH3H2O的电离平衡常数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 1mol N2 的质量是14g B. H2SO4的摩尔质量是98 g/mol
C. H2O的摩尔质量是18 D. 1mol HCl的质量是36.5 g /mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com