
【题目】某校化学实验兴趣小组为了要探究实验室制备 Cl2 的过程中会有水蒸气和 HCl 挥发出来,同时要 证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),按要求回答问题.
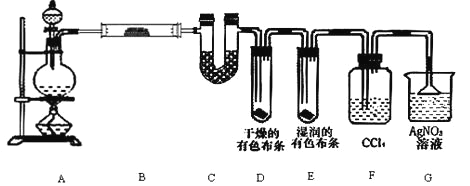
(1)若用含有 0.2mol HCl 的浓盐酸与足量的 MnO2 反应制 Cl2,制得的 Cl2 在标准状况下体积总 是________________1.12L(填“大于”或“等于”或“小于”),原因是________________。
(2)①装置 B 中盛放的试剂名称为__________,作用是________________
②装置 D 和 E 中出现的不同现象说明了________________
③装置 F 的作用是________________
④写出装置 G 中发生主要反应的离子方程式为________________.
(3)乙同学认为甲同学的实验有缺陷,不能确保最终通入 AgNO3 溶液中的气体只有一种.为了 确保实验结论的可靠性,证明最终通入 AgNO3 溶液的气体只有一种,乙同学提出在某两个装置之间 再加一个装置.你认为该装置应加在________________与________________之间(填装置字母序号),装置中应放入________________(填写试剂或用品名称).
【答案】 小于 随着反应的进行浓盐酸的浓度逐渐变稀,稀盐酸与 MnO2 不反应 无水硫酸铜 证明有水蒸气产生 氯气无漂白性,次氯酸有漂白性 吸收氯气 Ag++Cl-→AgCl↓ F G 湿润的淀粉 KI 试纸
【解析】(1)浓盐酸与足量MnO2反应制取Cl2,反应需要加热,氯化氢易挥发,反应消化氯化氢,随反应的不断进行浓盐酸的浓度逐渐变稀,稀盐酸不反应不与MnO2反应,制得的Cl2在标准状况下体积总是小于1.12L;
(2)①硫酸铜吸水生成蓝色硫酸铜晶体,检验含有水蒸气;
②干燥的有色布条不褪色,说明氯气不具有漂白性;湿润的有色布条褪色,氯气与水反应生成盐酸与次氯酸,盐酸不具有漂白性,所以使有色布条褪色的物质是次氯酸,故次氯酸漂白性;
③用四氯化碳吸收氯气,防止干扰G中氯化氢的检验;
④氯化氢与硝酸银反应生成氯化银和硝酸,反应离子方程式为Ag++Cl-═AgCl↓;
(3)氯气与水反应会生成盐酸,干扰G中氯化氢的检验,故在F、G之间加一装置,用碘化钾淀粉试液检验氯气是否被完全吸收。


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是
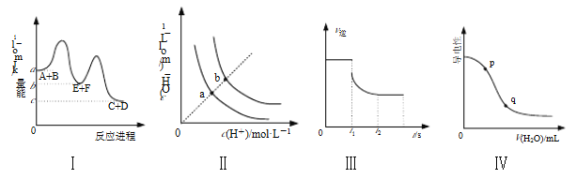
A. 图Ⅰ表示反应A+B=C+D的ΔH=(a-c) kJ·mol-1
B. 图Ⅱ表示不同温度下水溶液中H+和OH-的浓度变化曲线,图中a点对应温度高于b点
C. 图Ⅲ表示N2+3H2![]() 2NH3的v逆随时间变化曲线,由图知t1时刻可能减小了容器内的压强
2NH3的v逆随时间变化曲线,由图知t1时刻可能减小了容器内的压强
D. 图Ⅳ表示向醋酸稀溶液中加水时溶液的导电性变化,图中p点pH大于q点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属(M)﹣空气电池(如图)具有原料易得,能量密度高等优点,有望成为新能源汽车和移动设备的电源,该类电池放电的总反应方程式为:4M+nO2+2nH2O=4M(OH)n,已知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能,下列说法不正确的是( )

A. 采用多孔电极的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面
B. 比较Mg,Al,Zn三种金属﹣空气电池,Al﹣空气电池的理论比能量最高
C. M﹣空气电池放电过程的正极反应式:4M++nO2+2nH2O+4ne﹣=4M(OH)n
D. 在Mg﹣空气电池中,为防止负极区沉积Mg(OH)2,宜采用中性电解质及阳离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。 据此下列说法正确的)

A. 该试剂的物质的量浓度为 9.2 mol·L —1
B. 该硫酸 50 mL 与足量的铜反应可得到标准状况下 SO2 10.3 L
C. 配制 200 mL 4.6 mol·L —1 的稀硫酸需取该硫酸 50 mL
D. 该硫酸与等体积的水混合所得溶液的质量分数小于 49%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素形成的纯净物A、B、C、D、E,五种物质之间的转化关系如图所示,物质A与物质B之间的反应不在溶液中进行(E可能与A、B两种物质中的一种相同)。

请回答下列问题:
(1)若C是离子化合物,D是一种强碱,则C的化学式________,并任写一种C的主要用途 。
(2)若E的水溶液呈弱酸性,D是既能溶于强酸、又能溶于强碱的化合物。
①用电离方程式解释D既能溶于强酸、又能溶于强碱的原因(仅写出电离方程式即可): ________________________。
②用电荷守恒的等式表示E与NaOH溶液反应生成正盐的溶液中所有离子的浓度之间的关系:________________________________。
(3)若C是一种气体,D是一种强酸,则:
①C与水反应的化学方程式为_____________________________________。
②已知常温下物质A与物质B反应生成1 mol气体C的ΔH=-57 kJ·mol-1,1 mol气体C与H2O反应生成化合物D和气体E的ΔH=-46 kJ·mol-1,写出物质A与物质B及水反应生成化合物D的热化学方程式为__________________________________________。
③有人认为“浓H2SO4可以干燥气体C”。某同学为了验证该观点是否正确,用如图所示装置进行实验。
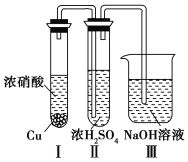
实验过程中,在浓H2SO4中未发现有气体逸出,则得出的结论是____________________________。
④用铂做电极电解H2SO4的溶液,其阳极的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有较大量的Mg2+、Ag+、Ba2+ 3种阳离子,欲将3种离子逐一沉淀出来,下列加入试剂的顺序中,正确的是
①NaOH溶液、NaCl溶液、Na2SO4溶液
②NaOH溶液、Na2SO4溶液、NaCl溶液
③NaCl溶液、Na2SO4溶液、NaOH溶液
④NaCl溶液、NaOH溶液、Na2SO4溶液
A.①② B.③④ C.①③ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[2016·新课标II卷]某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1 mol/L的溶液。在FeCl2溶液中需加入少量铁屑,其目的是__________________________。
(2)甲组同学取2 mL FeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为_______________________________。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2 mL FeCl2溶液中先加入0.5 mL煤油,再于液面下依次加入几滴氯水和l滴KSCN溶液,溶液变红,煤油的作用是______。
(4)丙组同学取10 mL 0.1 mol/L KI溶液,加入6 mL 0.1 mol/L FeCl3溶液混合。分别取2 mL此溶液于3 支试管中进行如下实验:
①第一支试管中加入1 mL CCl4充分振荡、静置,CCl4层呈紫色;
②第二支试管中加入1滴K3[Fe(CN)6] 溶液,生成蓝色沉淀:
③第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是__________(填离子符号);实验①和③说明:在I 过量的情况下,溶液中仍含有___________(填离子符号),由此可以证明该氧化还原反应为_____________________。
(5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为_______________________________;一段时间后,溶液中有气泡出现,并放热,随后有红褐色沉淀生成。产生气泡的原因是____________________________________________;生成沉淀的原因是___________________________________(用平衡移动原理解释)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.(1)研究钢铁的防腐蚀措施意义重大。利用如图所示装置可以模拟铁的电化学防护,其中Y为NaCl。
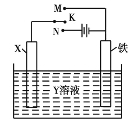
为减缓铁的腐蚀:
①若X为碳棒,开关K应置于 (填字母)处,此时X极发生的电极反应式为 。
②若X为锌,开关K置于M处,则此时铁极发生的电极反应式为 。
(2)在城市中地下常埋有纵横交错的管道和输电线路,地上还铺有铁轨,当有电流泄漏入潮湿的土壤中,并与金属管道形成回路时,就会引起后者的腐蚀。为表示其原理,某班级的学生绘制了下列装置图(假设电极材料均为铁,电解质溶液均为NaCl溶液)。
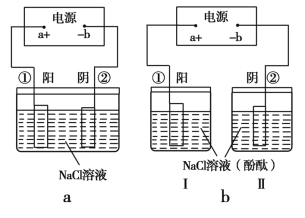
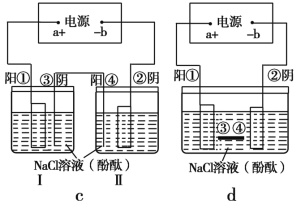
你认为其中能合理模拟金属管道的腐蚀原理的是 ;c(Ⅱ)的总反应方程式是 ;若图d 中接通电源,则平放的铁丝左侧附近产生的现象是 ;请你为防止地下金属管道腐蚀提供一种策略 。
Ⅱ.1 L某溶液中含有的离子如下表:
离子 | Cu2+ | Al3+ |
| Cl |
物质的量浓度/(mol/L) | 2 | 1 | 4 | x |
用惰性电极电解该溶液。当电路中有5 mol 电子通过时,溶液的pH= (忽略电解时溶液体积的变化及电极产物可能存在的溶解现象)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com