
【题目】铜、铁、铝是重要的金属材料,铜、铁、铝及其化合物有非常重要的用途。
(1)铁元素与氯元素可形成FeCl2和FeCl3两种化合物,下列说法正确的是 (填序号)。
① 保存FeCl2溶液时,需向溶液中加入少量Fe
② FeCl2只能通过置换反应生成,FeCl3只能通过化合反应生成
③ 铜片、碳棒和FeCl3溶液组成原电池,电子由铜片沿导线流向碳棒
④ 制备AlCl3、FeCl3、CuCl2均能采用将溶液直接蒸干的方法
⑤ 含a mol AlCl3的溶液和含1.5a mol NaOH的溶液,无论正滴和反滴,生成Al(OH) 3的质量相等
(2)高铁酸钾(K2FeO4)是一种高效多功能水处理剂。K2FeO4可以铁为电极,通过电解浓的KOH溶液来制取,写出电解法制取K2FeO4的阳极反应式: 。
(3)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为3FeS2+8O2 ![]() 6SO2+Fe3O4,有3 mol FeS2参加反应,转移________ mol电子。
6SO2+Fe3O4,有3 mol FeS2参加反应,转移________ mol电子。
(4)氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式为________________;从腐蚀废液回收得到金属铜,还需要的试剂是__________________________。
(5)工业上常用铝土矿(含SiO2等杂质)生产铝。从Na2SiO3和NaAlO2混合溶液中制得Al(OH)3,需要从下列试剂中选择两种,选用的试剂组合最好是 。
a. NaOH溶液 b.氨水 c. CO2 d. 盐酸
(6)已知25 ℃时Ksp[Mg(OH)2]=5.6×1012,Ksp[Cu(OH)2]=2.2×1020,Ksp[Fe(OH)3]=4.0×1038,Ksp[Al(OH)3]=1.1×1033
①在25 ℃下,向浓度均为0.1 mol·L1的AlCl3和CuCl2混合溶液中逐滴加入氨水,先生成________沉淀(填化学式)。
②用MgCl2、AlCl3的混合溶液(A) 与过量氨水(B) 反应,为使Mg2+、Al3+同时生成沉淀,应先向沉淀反应器中加入________(填“A”或“B”),再滴加另一反应物。
③溶液中某离子物质的量浓度低于1.0×105 mol·L1时,可认为已沉淀完全。现向一定浓度的AlCl3和FeCl3的混合溶液中逐滴加入氨水,当Fe3+完全沉淀时,测定c(Al3+)=0.2 mol·L1。此时所得沉淀中________(填“还含有”或“不含有”)Al(OH)3。
【答案】(1)①③⑤
(2)Fe + 8OH 6e![]()
![]() + 4H2O
+ 4H2O
(3)32
(4)2Fe3++Cu![]() 2Fe2++Cu2+ 铁粉、稀盐酸(稀硫酸)
2Fe2++Cu2+ 铁粉、稀盐酸(稀硫酸)
(5) d b
(6) ① Al(OH)3 ② B ③ 不含有
【解析】本题考查铜、铁、铝及其化合物的性质。(1)保存FeCl2溶液时,向溶液中加入少量Fe目的是防止Fe2+被氧化成Fe3+,故①正确;FeCl2可以通过Fe+2HCl![]() FeCl2+H2↑置换反应生成也可以通过2FeCl3+Fe
FeCl2+H2↑置换反应生成也可以通过2FeCl3+Fe![]() 3 FeCl2,故②错误;铜片、碳棒和FeCl3溶液组成原电池,铜片做负极,碳棒做正极,电子由负极流向正极即电子由铜片沿导线流向碳棒,故③正确;AlCl3、FeCl3、CuCl2不能采用将溶液直接蒸干的方法得到,因为阳离子水解,只能得到对应的氢氧化物,故④错误;根据 AlCl3+3NaOH
3 FeCl2,故②错误;铜片、碳棒和FeCl3溶液组成原电池,铜片做负极,碳棒做正极,电子由负极流向正极即电子由铜片沿导线流向碳棒,故③正确;AlCl3、FeCl3、CuCl2不能采用将溶液直接蒸干的方法得到,因为阳离子水解,只能得到对应的氢氧化物,故④错误;根据 AlCl3+3NaOH![]() Al(OH)3↓+3NaCl,含a mol AlCl3的溶液和含1.5a mol NaOH的溶液反应,NaOH不足,故无论正滴和反滴,生成的Al(OH) 3的质量相等。故⑤正确。
Al(OH)3↓+3NaCl,含a mol AlCl3的溶液和含1.5a mol NaOH的溶液反应,NaOH不足,故无论正滴和反滴,生成的Al(OH) 3的质量相等。故⑤正确。
(2)Fe做电极,KOH为电解质溶液,故阳极反应为Fe + 8OH 6e![]()
![]() + 4H2O。
+ 4H2O。
(3)3FeS2+8O2![]() 6SO2+Fe3O4中,Fe、S元素的化合价升高,O元素的化合价降低,3 mol FeS2参加反应,由O元素的化合价变化可知,转移的电子为8 mol×2×(20)=32 mol。
6SO2+Fe3O4中,Fe、S元素的化合价升高,O元素的化合价降低,3 mol FeS2参加反应,由O元素的化合价变化可知,转移的电子为8 mol×2×(20)=32 mol。
(4)氯化铁溶液与铜反应生成氯化铜和氯化亚铁,该离子反应为2Fe3++Cu![]() 2Fe2++Cu2+,利用置换反应得到,过量铁粉利用盐酸或硫酸除去,则选试剂为铁粉、稀盐酸(稀硫酸)。
2Fe2++Cu2+,利用置换反应得到,过量铁粉利用盐酸或硫酸除去,则选试剂为铁粉、稀盐酸(稀硫酸)。
(5)从Na2SiO3和NaAlO2混合溶液中制得Al(OH)3,先利用盐酸使Na2SiO3变为H2SiO3沉淀而NaAlO2变为Al3+,过滤除去H2SiO3,再加入氨水使Al3+转化为Al(OH)3沉淀。不使用NaOH溶液的原因是NaOH量不好控制,Al(OH)3会溶于NaOH而不溶氨水。故答案为db。
(6)① 根据题意Ksp[Cu(OH)2]=2.2×1020,Ksp[Al(OH)3]=1.1×1033对于AlCl3开始沉淀时需要的[OH]3= Ksp[Al(OH)3]/[Al3+]=1.1×1033÷0.1=11×1033,[OH]≈2.22×1011;对于CuCl2开始沉淀时需要的[OH]2= Ksp[Cu(OH)2]/[Cu2+]=2.2×1020÷0.1=22×1020,[OH]≈4.69×1010,故Al(OH)3先沉淀。②用MgCl2、AlCl3的混合溶液(A) 与过量氨水(B) 反应,由于Ksp不同为使Mg2+、Al3+同时生成沉淀,应先向沉淀反应器中加入过量氨水(B),使氢氧根足量,才能同时沉淀。③向一定浓度的AlCl3和FeCl3的混合溶液中逐滴加入氨水,当Fe3+完全沉淀时,[OH]3= Ksp[Fe(OH)3]=4.0×1038/1.0×105=4.0×1033,


科目:高中化学 来源: 题型:
【题目】[化学——选修5:有机化学基础](15分)
氟他胺G是一种可用于治疗肿瘤的药物。实验室由芳香烃A制备G的合成路线如下:
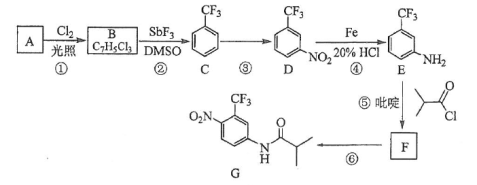
回答下列问题:
(1)A的结构简式为____________。C的化学名称是______________。
(2)③的反应试剂和反应条件分别是____________________,该反应的类型是__________。
(3)⑤的反应方程式为_______________。吡啶是一种有机碱,其作用是____________。
(4)G的分子式为______________。
(5)H是G的同分异构体,其苯环上的取代基与G的相同但位置不同,则H可能的结构有______种。
(6)4-甲氧基乙酰苯胺(![]() )是重要的精细化工中间体,写出由苯甲醚(
)是重要的精细化工中间体,写出由苯甲醚(![]() )制备4-甲氧基乙酰苯胺的合成路线___________(其他试剂任选)。
)制备4-甲氧基乙酰苯胺的合成路线___________(其他试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(12分)
SCR和NSR技术可有效降低柴油发动机在空气过量条件下的NOx排放。
(1)SCR(选择性催化还原)工作原理:
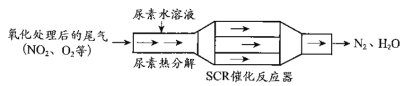
① 尿素[CO(NH2)2]水溶液热分解为NH3和CO2,该反应的化学方程式:____________。
② 反应器中NH3还原CO2的化学方程式:____________。
③ 当燃油中含硫量较高时,尾气中SO2在O2作用下会形成(NH4)2SO4,使催化剂中毒。用化学方程式表示(NH4)2SO4的形成:________。
④ 尿素溶液浓度影响NO2的转化,测定溶液中尿素(M=60 mg·L1)含量的方法如下:取a g尿素溶液,将所含氮完全转化为NH3,所得NH3用过量的v1 mL c1 mol·L1 H2SO4溶液吸收完全,剩余H2SO4用v2 mL c2 mol·L1 NaOH溶液恰好中和,则尿素溶液中溶质的质量分数是_________。
(2)NSR(NOx储存还原)工作原理:
NOx的储存和还原在不同时段交替进行,如图a所示。
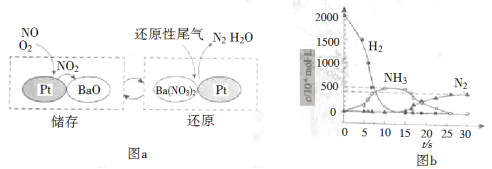
① 通过BaO和Ba(NO3)2的相互转化实验NOx的储存和还原。储存NOx的物质是_________。
② 用H2模拟尾气中还原性气体研究了Ba(NO3)2的催化还原过程,该过程分两步进行,图b表示该过程相关物质浓度随时间的变化关系。第一步反应消耗的H2与Ba(NO3)2的物质的量之比是__________。
③ 还原过程中,有时会产生笑气(N2O)。用同位素示踪法研究发现笑气的产生与NO有关。在有氧条件下15NO与NH3以一定比例反应时,得到的笑气几乎都是15NNO。将该反应的化学方程式补充完整:_______![]() □15NNO+□H2O
□15NNO+□H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是
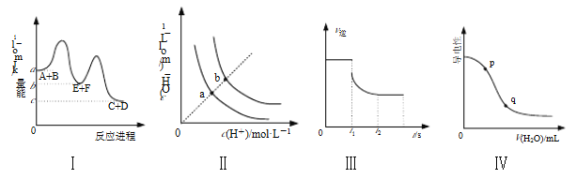
A. 图Ⅰ表示反应A+B=C+D的ΔH=(a-c) kJ·mol-1
B. 图Ⅱ表示不同温度下水溶液中H+和OH-的浓度变化曲线,图中a点对应温度高于b点
C. 图Ⅲ表示N2+3H2![]() 2NH3的v逆随时间变化曲线,由图知t1时刻可能减小了容器内的压强
2NH3的v逆随时间变化曲线,由图知t1时刻可能减小了容器内的压强
D. 图Ⅳ表示向醋酸稀溶液中加水时溶液的导电性变化,图中p点pH大于q点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. CO2、NO2或SO2都会导致酸雨的形成 B. 木材浸过水玻璃后,具有良好的防火性能
C. 石英坩埚、水泥、陶瓷都是硅酸盐产品 D. 氯气泄漏后,人应逆风且往低处跑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由C、H、O三种元素组成的某有机物A,在一定条件下,可以转化为有机物B、C和D、E;C又可以转化为B、A。它们的转化关系如下:

已知D的蒸气密度是氢气的22倍,并可以发生银镜反应。
(1)写出下列物质的结构简式:C____, D____;
(2)C→B的反应类型为____;
(3)写出下列转化的化学方程式:
C→A________________________,
A→D________________________,
A+E→F_____________________;
(4)请写出与F具有相同官能团的所有同分异构体的结构简式(不含F):
_________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属(M)﹣空气电池(如图)具有原料易得,能量密度高等优点,有望成为新能源汽车和移动设备的电源,该类电池放电的总反应方程式为:4M+nO2+2nH2O=4M(OH)n,已知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能,下列说法不正确的是( )

A. 采用多孔电极的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面
B. 比较Mg,Al,Zn三种金属﹣空气电池,Al﹣空气电池的理论比能量最高
C. M﹣空气电池放电过程的正极反应式:4M++nO2+2nH2O+4ne﹣=4M(OH)n
D. 在Mg﹣空气电池中,为防止负极区沉积Mg(OH)2,宜采用中性电解质及阳离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[2016·新课标II卷]某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1 mol/L的溶液。在FeCl2溶液中需加入少量铁屑,其目的是__________________________。
(2)甲组同学取2 mL FeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为_______________________________。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2 mL FeCl2溶液中先加入0.5 mL煤油,再于液面下依次加入几滴氯水和l滴KSCN溶液,溶液变红,煤油的作用是______。
(4)丙组同学取10 mL 0.1 mol/L KI溶液,加入6 mL 0.1 mol/L FeCl3溶液混合。分别取2 mL此溶液于3 支试管中进行如下实验:
①第一支试管中加入1 mL CCl4充分振荡、静置,CCl4层呈紫色;
②第二支试管中加入1滴K3[Fe(CN)6] 溶液,生成蓝色沉淀:
③第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是__________(填离子符号);实验①和③说明:在I 过量的情况下,溶液中仍含有___________(填离子符号),由此可以证明该氧化还原反应为_____________________。
(5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为_______________________________;一段时间后,溶液中有气泡出现,并放热,随后有红褐色沉淀生成。产生气泡的原因是____________________________________________;生成沉淀的原因是___________________________________(用平衡移动原理解释)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com