
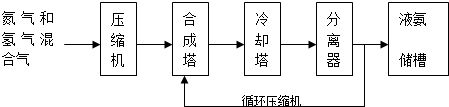
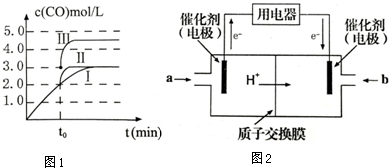
分析 (1)①a条件下,0~t0的平均反应速率v(N2)=v(H2)=$\frac{1}{3}$×$\frac{△c}{△t}$;
②a、b氢气起始浓度相同,b到达平衡的时间缩短,说明反应速率增大,平衡时氢气的正向移动;
③在a条件下t1时刻将容器体积压缩至原来的$\frac{1}{2}$,氢气浓度增大,压强增大平衡正向进行,氢气浓度减小,t2时刻重新建立平衡状态,浓度大于c1,据此画出图象变化;
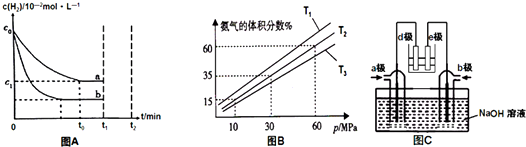
(2)①若体系在T2、60MPa下达到平衡,相同温度下,气体的体积分数等于其物质的量分数,
设平衡时n(NH3)=xmol,
N2(g)+3H2(g)?2NH3(g)
开始(mol) 9 23 0
反应(mol) 0.5x 1.5x x
平衡(mol)9-0.5x 23-1.5x x
平衡时氨气体积分数=$\frac{x}{9-0.5x+23-1.5x+x}$×100%=60%,
x=12,
氮气分压=$\frac{9-0.5×12}{9+23-12}$×60MPa;
②此时的平衡常数Kp等生成物压强幂之积与反应物压强幂之积的比;
(3)分离器中的过程是分离出氨气促进平衡正向进行,提高原料利用率和产物的产量;
(4)根据图知,d极为粗铜,为电解池的阳极,e为精铜,为电解池阴极,d为阳极,所以通入a的电极是正极、通入b的电极是负极,原电池中NH3和NO2构成原电池,负极上氨气失电子发生氧化反应,正极上二氧化氮得电子发生还原反应.
解答 解:(1)①a条件下,0~t0的平均反应速率v(N2)=$\frac{1}{3}$v(H2)=$\frac{1}{3}$×$\frac{△c}{△t}$=$\frac{1}{3}$×$\frac{({c}_{0}-{c}_{1})mol/L}{100{t}_{0}min}$=$\frac{{c}_{0}-{c}_{1}}{300{t}_{0}}$mol/(L.min),
故答案为:$\frac{{c}_{0}-{c}_{1}}{300{t}_{0}}$;
②a、b氢气起始浓度相同,b到达平衡的时间缩短,说明反应速率增大,平衡时氢气的浓度减小,说明平衡正向移动,所以改变的条件是增大c(N2),
故答案为:增大c(N2);
( ③在a条件下t1时刻将容器体积压缩至原来的$\frac{1}{2}$,t2时刻重新建立平衡状态,t1时刻变成2c1,t1~t2时刻的趋势逐渐减小,终点达到新的平衡时浓度大于c1,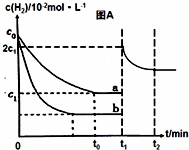 ,
,
故答案为: ;
;
(2)①若体系在T2、60MPa下达到平衡,相同温度下,气体的体积分数等于其物质的量分数,
设平衡时n(NH3)=xmol,
N2(g)+3H2(g)?2NH3(g)
开始(mol)9 23 0
反应(mol)0.5x 1.5x x
平衡(mol)9-0.5x 23-1.5x x
平衡时氨气体积分数=$\frac{x}{9-0.5x+23-1.5x+x}$×100%=60%,
x=12,
氮气分压=$\frac{9-0.5×12}{9+23-12}$×60MPa=9MPa;
氨气的分压=60%×60MPa=36MPa,
氢气分压=60MPa-9MPa-36MPa=15MPa,
此时的平衡常数Kp=$\frac{(36MPa)^{2}}{(9MPa)(15MPa)^{3}}$=0.043(MPa)-2,
故答案为:9; 15;0.043(MPa)-2;
(3)分离器中的过程是分离出氨气促进平衡正向进行,及时分离出液氨,c(NH3)减小,使平衡往生成NH3的方向移动,增大原料利用率(或NH3产率);
故答案为:及时分离出液氨,c(NH3)减小,使平衡往生成NH3的方向移动,增大原料利用率(或NH3产率);
(4)①根据图知,e为精铜,为电解池阴极,d为阳极,所以通入a的电极是正极、通入b的电极是负极,原电池中NH3和NO2构成原电池,负极上失电子发生氧化反应,正极上得电子发生还原反应,原电池中二氧化氮得电子生成氮气,氨气失电子生 成氮气,所以a电极上通入的是NO2,
故答案为:NO2;
②d为粗铜,电极上发生氧化反应,电极电极e为精铜,电极上发生还原反应,则a极为正极,正极上二氧化氮得电子生成氮气,b电极是氨气失电子发生氧化反应生成氮气,电极反应为:2NH3-6e-+6OH-=N2+6H2O;
故答案为:2NH3-6e-+6OH-=N2+6H2O.
点评 本题考查了化学反应速率、化学平衡的计算和影响因素分析、原电池和电解池原理的分析、图象的理解应用,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 在我国上海举办的世博会采取了许多节能环保措施,充分利用太阳能是其中之一 | |
| B. | 氧化铝陶瓷是一种超硬物质,能抵抗冷热冲击,是一种高压钠灯灯管的良好材料 | |
| C. | 空气污染指数的项目包括:二氧化硫、二氧化氮和可吸入颗粒物等 | |
| D. | 为了防止食物腐败,可以向食品中加入大量的NaNO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用NaOH溶液吸收汽车尾气中的NO2:2NO2+2OH-═NO3-+NO↑+H2O | |
| B. | 向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+2H2O═2Al(OH)3↓+HCO3- | |
| C. | 澄清石灰水和硝酸反应:Ca(OH)2+2H+═Ca2++2H2O | |
| D. | 向Na2SO3溶液中加人过量酸性KMnO4溶液:5SO32-+6H++2MnO4-═5SO42-+2Mn2++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 称40.0 g 氢氧化钠固体解于1L水中配成1L的氢氧化钠溶液 | |
| B. | 常温常压下将22.4L氯化氢气体溶于水配成1L的盐酸溶液 | |
| C. | 将1L 10mol/L的浓盐酸与水混合配成10L溶液 | |
| D. | 从1000mL 2mol/L NaCl溶液中取出500mL的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 CH4和H2O(g)可发生催化重整反应:CH4(g)+H2O(g)?CO(g)+3H2(g).
CH4和H2O(g)可发生催化重整反应:CH4(g)+H2O(g)?CO(g)+3H2(g).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作、现象 | 结论 |
| A | 某溶液加入稀盐酸产生能使澄清石灰水变浑浊的无色无味气体;另取原溶液少许,向其中滴加CaCl2溶液,有白色沉淀生成 | 确定该溶液存在CO32- |
| B | 氯水中存在多种分子和离子,向新制氯水中加入有色布条,片刻后有色布条褪色 | 说明氯水中有HClO存在 |
| C | 将淀粉与KCl混合液装于半透膜内,浸泡在盛蒸馏水的烧杯中,5min后取烧杯中液体,加碘水变蓝色 | 证明半透膜有破损 |
| D | 将气体通入盛饱和碳酸钠溶液的洗气瓶 | 可用于除去中CO2的HCl |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
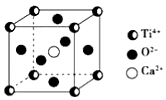 CaTiO3的晶体结构模型如图所示(图中Ca2+、O2-、Ti4+分别位于立方体的体心、面心和顶角),下列关于晶体的说法正确的是( )
CaTiO3的晶体结构模型如图所示(图中Ca2+、O2-、Ti4+分别位于立方体的体心、面心和顶角),下列关于晶体的说法正确的是( )| A. | CaTiO3的摩尔质量为136 | |
| B. | CaTiO3晶体中每个Ti4+与12个Ca2+紧相邻 | |
| C. | CaTiO3晶体中每个Ti4+与12个O2-紧相邻 | |
| D. | CaTiO3晶体中每个Ti4+与12个Ti4+紧相邻 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com