
| A. | 用NaOH溶液吸收汽车尾气中的NO2:2NO2+2OH-═NO3-+NO↑+H2O | |
| B. | 向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+2H2O═2Al(OH)3↓+HCO3- | |
| C. | 澄清石灰水和硝酸反应:Ca(OH)2+2H+═Ca2++2H2O | |
| D. | 向Na2SO3溶液中加人过量酸性KMnO4溶液:5SO32-+6H++2MnO4-═5SO42-+2Mn2++3H2O |
分析 A.二氧化氮与氢氧化钠反应生成亚硝酸钠、硝酸钠和水;
B.电荷不守恒;
C.澄清石灰水中氢氧化钙应拆成离子形式;
D.高锰酸钾具有强的氧化性能够氧化亚硫酸根离子生成硫酸根离子,本身被还原为二价锰离子.
解答 解:A.用NaOH溶液吸收汽车尾气中的NO2,离子方程式:2NO2+2OH-═NO3-+NO2-+H2O,故A错误;
B.向NaAlO2溶液中通入过量CO2,离子方程式:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,故B错误;
C.澄清石灰水和硝酸反应,离子方程式:OH-+H+═H2O,故C错误;
D.向Na2SO3溶液中加人过量酸性KMnO4溶液,离子方程式为5SO32-+6H++2MnO4-═5SO42-+2Mn2++3H2O,故D正确;
故选:D.
点评 本题考查了离子方程式的书写,明确反应实质是解题关键,注意物质化学式的拆分,注意反应物用量对反应的影响,题目难度中等.


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案科目:高中化学 来源: 题型:选择题
| A. | 向品红溶液中通入气体X,品红溶液褪色,则气体X可能是Cl2 | |
| B. | CO2中含少量SO2,可将该混合气体通人足量饱和NaHCO3溶液中除去SO2: | |
| C. | 用洁净的铂丝蘸取某食盐试样,在酒精灯火焰上灼烧,火焰显黄色,说明该食盐试样中不含KIO3 | |
| D. | 相同体积、pH均为3的HA和HB两种酸的溶液分别与足量的锌充分反应,HA放出的氢气多,说明HB的酸性比HA的酸性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
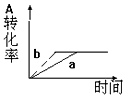 已知某可逆反应在密闭容器中进行:A(g)+2B(g)?3C(g)+D(s)△H<0,图中曲线a 代表一定条件下该反应的过程,若使a曲线变为b曲线,可采用的措施是( )
已知某可逆反应在密闭容器中进行:A(g)+2B(g)?3C(g)+D(s)△H<0,图中曲线a 代表一定条件下该反应的过程,若使a曲线变为b曲线,可采用的措施是( )| A. | 增大A的浓度或减少C的浓度 | B. | 缩小容器的容积或加入催化剂 | ||
| C. | 升高温度或增大压强 | D. | 升高温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ①②④ | C. | ②④⑤ | D. | ①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
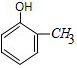 2-甲基苯酚、
2-甲基苯酚、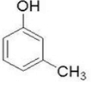 3-甲基苯酚、
3-甲基苯酚、 4-甲基苯酚.
4-甲基苯酚.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
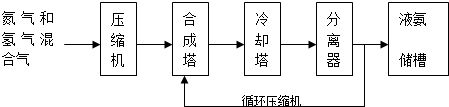
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.3mol | B. | 0.15mol | ||
| C. | 小于0.15mol | D. | 大于0.15mol,小于0.3mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com