
| A. | 向品红溶液中通入气体X,品红溶液褪色,则气体X可能是Cl2 | |
| B. | CO2中含少量SO2,可将该混合气体通人足量饱和NaHCO3溶液中除去SO2: | |
| C. | 用洁净的铂丝蘸取某食盐试样,在酒精灯火焰上灼烧,火焰显黄色,说明该食盐试样中不含KIO3 | |
| D. | 相同体积、pH均为3的HA和HB两种酸的溶液分别与足量的锌充分反应,HA放出的氢气多,说明HB的酸性比HA的酸性强 |
分析 A.具有强氧化性的气体能够使品红溶液褪色;
B.二氧化硫与碳酸氢钠反应,而二氧化碳不反应;
C.观察钾离子的焰色反应火焰颜色时,需要通过蓝色钴玻璃;
D.相同体积、pH均为3的HA和HB两种酸与质量锌反应,放出氢气越大,说明酸的电离程度越弱.
解答 解:A.向品红溶液中通入气体X,品红溶液褪色,说明该气体具有强氧化性,该气体可能是Cl2,故A正确;
B.SO2与碳酸氢钠溶液反应,二氧化碳不反应,将该混合气体通人足量饱和NaHCO3溶液中除去CO2中少量的SO2,故B正确;
C.用洁净的铂丝蘸取某食盐试样,在酒精灯火焰上灼烧,火焰显黄色,说明溶液中含有钠离子,但是无法判断该溶液中是否KIO3,需要通过蓝色钴玻璃观察钾离子火焰颜色,故C错误;
D.相同体积、pH均为3的HA和HB两种酸的溶液分别与足量的锌充分反应,HA放出的氢气多,说明HA的电离程度较弱,则HB的酸性比HA的酸性强,故D正确;
故选C.
点评 本题考查了化学实验方案评价,题目难度中等,涉及漂白性、物质除杂、焰色反应、酸性强弱判断等知识,明确常见元素及其化合物性质为解答关键,试题培养了学生的分析能力及化学实验能力.


科目:高中化学 来源: 题型:解答题
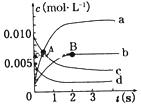 在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO) 随时间的变化如表:
在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO) 随时间的变化如表:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
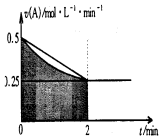
| A. | 0-2min,速率不断减少的主要原因是A的浓度减少 | |
| B. | 反应开始前2min,C的浓度增加量等于A的浓度减少量 | |
| C. | 至2min时,A的物质的量减小值可能是0.5mol | |
| D. | 至2min时,c(B)介于1mol•L-1 至1.5mol•L-1 之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在我国上海举办的世博会采取了许多节能环保措施,充分利用太阳能是其中之一 | |
| B. | 氧化铝陶瓷是一种超硬物质,能抵抗冷热冲击,是一种高压钠灯灯管的良好材料 | |
| C. | 空气污染指数的项目包括:二氧化硫、二氧化氮和可吸入颗粒物等 | |
| D. | 为了防止食物腐败,可以向食品中加入大量的NaNO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3(g)与HCl(g)反应生成NH4Cl(s) | B. | 氯化钠溶于水中 | ||
| C. | CaCO3(S)分解为CaO(S)和CO2(g) | D. | 干冰(CO2)的升华 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用蒸发水分的方法使海水中的盐析出 | |
| B. | 用加热蒸馏的方法,从工业酒精中获得95.6%的乙醇 | |
| C. | 用加热升华的方法把单质碘从它和碘化钾固体形成的混合物中分离出来 | |
| D. | 用加热的方法,把掺杂在NaCl固体中的少量NH4HCO3固体除去 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用NaOH溶液吸收汽车尾气中的NO2:2NO2+2OH-═NO3-+NO↑+H2O | |
| B. | 向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+2H2O═2Al(OH)3↓+HCO3- | |
| C. | 澄清石灰水和硝酸反应:Ca(OH)2+2H+═Ca2++2H2O | |
| D. | 向Na2SO3溶液中加人过量酸性KMnO4溶液:5SO32-+6H++2MnO4-═5SO42-+2Mn2++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com