
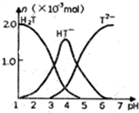
 常温下,向10ml0.2mol•L-1草酸(用H2T表示)溶液中逐滴加入等浓度的NaOH溶液.有关微粒的物质的量与混合溶液的PH有如图关系,下列说法正确的是( )
常温下,向10ml0.2mol•L-1草酸(用H2T表示)溶液中逐滴加入等浓度的NaOH溶液.有关微粒的物质的量与混合溶液的PH有如图关系,下列说法正确的是( )| A. | HT-在溶液中水解程度大于电离程度 | |
| B. | 当V(NaOH)=10mL时,溶液中水的电离程度比纯水大 | |
| C. | 当V(NaOH)=15mL时,溶液中存在:c(Na+)>c(HT-)>c(T2-)>c(OH-)>c(H+) | |
| D. | 当V(NaOH)=20mL时,溶液中存在:c(OH-)=c(HT-)+2c(H2T)+c(H+) |
分析 A.根据图示信息得到HT-在溶液中存在时的pH进行分析;
B.加入10mLNaOH溶液,反应生成NaHT,溶液呈酸性,抑制了水的电离;
C.当V(NaOH)=15mL时,溶质为等浓度的Na2T和NaHT,溶液还呈酸性,c(H+)>c(OH-);
D.当V(NaOH)=20mL时,恰好反应生成的溶质为Na2T,依据质子守恒来回答.
解答 解:A.根据图示信息得到HT-在溶液中存在时的pH<7,所以HT-在溶液中水解程度小于电离程度,故A错误;
B.VNaOH=10mL时,反应后溶质为NaHT,HT-在溶液中水解程度小于电离程度,溶液呈酸性,抑制了水的电离,则溶液中水的电离程度比纯水小,故B错误;
C.当V(NaOH)=15mL时,溶质为等浓度的Na2T和NaHT,溶液呈酸性,则c(H+)>c(OH-)、c(T2-)>c(HT-),溶液中离子浓度大小为:c(Na+)>c(T2-)>c(HT-)>c(H+)>c(OH-),故C错误;
D、VNaOH=20mL时,与氢氧化钠溶液恰好反应,溶液中溶质为Na2T,图象分析可知溶液呈碱性,依据质子守恒可知:c(OH-)=c(HT-)+2c(H2T)+c(H+),故D正确;
故选D.
点评 本题考查酸碱混合溶液定性判断,为高考常见题型,题目难度中等,试题侧重于学生的分析能力的考查,明确图象中酸碱混合时溶液中的溶质是解答本题的关键,抓住图象进行分析即可.


科目:高中化学 来源: 题型:选择题
| A. | ①②③中氧化产物分别是FeCl2、Fe3+、Cl2 | |
| B. | 根据以上反应的化学方程式可以得到氧化性强弱关系为Cl2>Co2O3>Fe3+ | |
| C. | 在反应③中生成1 mol Cl2时,有2 mol HCl被氧化 | |
| D. | 根据反应①②一定可以推理得到Cl2+FeBr2═FeCl2+Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 | v(H2C2O4) | v(KMnO4) | KMnO4褪色时间 |
| 40℃ | 10mL | 10mL | 40s |
| 40℃ | 20mL | 20mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应中,有三种元素化合价发生改变 | |
| B. | 该反应的氧化剂为BrF3,氧化产物为O2 | |
| C. | 1.5molBrF3参加反应,有4mole一转移 | |
| D. | 1.5molH2O参加反应,被H2O还原的BrF3为0.4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Z>X>Y | B. | X>Y>Z | C. | Y>X>Z | D. | Y>Z>X |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NA个18O2和NA个NO的质量比为16:15 | |
| B. | 标准状况下1molCO和CO2的混合物的体积约占22.4L | |
| C. | 24gMg在足量空气中完全燃烧失去2NA个电子 | |
| D. | 常温下,18gH2O含有的电子数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com