
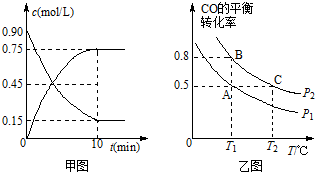
���� ��1�����ø�˹���ɣ�1ʽ��2ʽ�Ķ������ɵõ��÷���ʽ���ʱ䣻
��2�����ݷ�Ӧ����v=$\frac{��c}{��t}$��������ʱ�ʾ�ķ�Ӧ����֮�ȵ�������ǰ�ߵ�ϵ��֮�������㣻
��3����ƽ���־�����淴Ӧ������ͬ�����ɷ�Ũ�ȱ��ֲ�������ж�ѡ�
������Ӧ����Ϊ���������С�ķ���T1��ʱ�Ƚ�CO��ת���ʣ�ת����Խ����ѹǿԽ��
��A��B��Ӧ�¶���ȣ���ƽ�ⳣ����ȣ�����ƽ�ⳣ�����㣻
��4����ȼ�ϵ���ܷ�Ӧ��ȼ��ȼ�յĻ�ѧ����ʽ���ڼ��Ի����£�������̼ת��Ϊ̼������ӣ��ݴ���д��
�ڵ���0.5mol�״����뷴Ӧʱ�������Ķ�����̼��0.5mol����0.8mol�������ط�Ӧ������Ԫ���غ���Լ���n ��K2CO3��=0.3mol��n ��KHCO3��=0.2mol���ݴ�ȷ������Ũ�ȵĴ�С˳��
��� �⣺��1����֪��2CH4��g��+O2��g��=2CO��g��+4H2��g����H=a KJ/mol
��CO��g��+2H2��g��=CH3OH��g����H=b KJ/mol����+�ڡ�2�ɵõ�2CH4��g��+O2��g��=2CH3OH��g����H=��a+2b��kJ/mol��
�ʴ�Ϊ��2CH4��g��+O2��g��=2CH3OH��g����H=��a+2b��kJ/mol��
��2���ü״���ʾ�ķ�Ӧ����v=$\frac{0.75mol/L}{10min}$=0.075mol/��L•min����������ʾ�ķ�Ӧ�����Ǽ״���2������0.15mol/��L•min����
�ʴ�Ϊ��0.15mol/��L•min����
��3����A��H2���������ʵ���CH3OH���������ʵ�2��������˵�����淴Ӧ������ȣ���һ��ƽ�⣬��A����
B��H2������������ٸı��ǻ�ѧƽ����������ﵽ��ƽ�⣬��B��ȷ��
C����ϵ��H2��ת���ʺ�CO��ת������ȣ�����˵�����淴Ӧ������ȣ���һ��ƽ�⣬��C����
D����ϵ�������ƽ��Ħ�������������������ʵ����ı�ֵ�����ʵ����仯���������䣬���Ե���ϵ�������ƽ��Ħ���������ٸı䣬֤���ﵽ��ƽ�⣬��D��ȷ��
��ѡBD��
������Ӧ����Ϊ���������С�ķ���T1��ʱ�Ƚ�CO��ת���ʣ�ת����Խ����ѹǿԽ��ͼ����PBת���ʴ���PA����֪PA��PB���ʴ�Ϊ������
��A��B�������¶���ͬ������ѧƽ�ⳣ����ȣ���B��ʱCO��ת����Ϊ0.8��
�� CO��g��+2H2��g��?CH3OH��g��
��ʼ��mol����10 20 0
ת����mol����8 16 8
ƽ�⣨mol����2 4 8
�����ΪVL������K=$\frac{\frac{8}{V}}{\frac{2}{V}����\frac{4}{V}��^{2}}$=4��V=4L��
�ʴ�Ϊ��4��
��4����4����ȼ�ϵ���ܷ�Ӧ��ȼ��ȼ�յĻ�ѧ����ʽ���ڼ��Ի����£�������̼ת��Ϊ̼������ӣ���2CH3OH+3O2+4OH-=2CO32-+6H2O��
�ʴ�Ϊ��2CH3OH+3O2+4OH-=2CO32-+6H2O��
�ڵ���0.5mol�״����뷴Ӧʱ�������Ķ�����̼��0.5mol����0.8mol�������ط�Ӧ������Ԫ���غ���Լ���n ��K2CO3��=0.3mol��n ��KHCO3��=0.2mol�����ߵ�ˮ��Һ��Ϊ���ԣ�����C��K+����C��CO32-����C��HCO3-����C��OH-����C��H+����
�ʴ�Ϊ��C��K+����C��CO32-����C��HCO3-����C��OH-����C��H+����
���� ������Ҫ�������Ȼ�ѧ����ʽ����д���������Һ������Ũ�ȴ�С�Ƚϡ�ԭ���ԭ����������ѧƽ��״̬���ж��Լ�ƽ��ļ����֪ʶ�������ۺ�֪ʶ�Ŀ��飬��Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
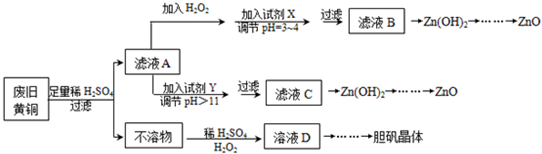
| Fe3+ | Fe2+ | Zn2+ | |
| ��ʼ������pH | 1.1 | 5.8 | |
| ������ȫ��pH | 3.0 | 8.8 | 8.9 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ͭ��ˮ��ͷ���Ӵ��ĸ���ˮ��������ʴ | |
| B�� | ������̼�����顢���������������ЧӦ������ | |
| C�� | �ڹ�ҵ�����У����Ƴ��ڽϵ��¶Ⱥ�ѹǿ����ʹ��ӦѸ�ٽ��еĴ��������ܺõĽ���Ч����������ʮ�˴�����ġ���ɫ��չ������ | |
| D�� | ʯ���ѽ⡢ú����������ˮ��þ��������ѧ�仯 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
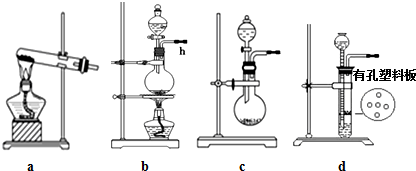
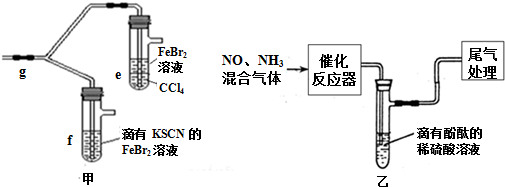
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
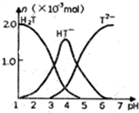 �����£���10ml0.2mol•L-1���ᣨ��H2T��ʾ����Һ����μ����Ũ�ȵ�NaOH��Һ���й��������ʵ���������Һ��PH����ͼ��ϵ������˵����ȷ���ǣ�������
�����£���10ml0.2mol•L-1���ᣨ��H2T��ʾ����Һ����μ����Ũ�ȵ�NaOH��Һ���й��������ʵ���������Һ��PH����ͼ��ϵ������˵����ȷ���ǣ�������| A�� | HT-����Һ��ˮ��̶ȴ��ڵ���̶� | |
| B�� | ��V��NaOH��=10mLʱ����Һ��ˮ�ĵ���̶ȱȴ�ˮ�� | |
| C�� | ��V��NaOH��=15mLʱ����Һ�д��ڣ�c��Na+����c��HT-����c��T2-����c��OH-����c��H+�� | |
| D�� | ��V��NaOH��=20mLʱ����Һ�д��ڣ�c��OH-��=c��HT-��+2c��H2T��+c��H+�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
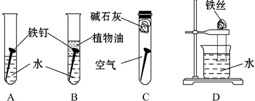 ij�о���ѧϰС�������������о���
ij�о���ѧϰС�������������о����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | HCl�TH++Cl- | B�� | NH3•H2O�TNH4++OH- | ||
| C�� | CaCl2=Ca2++2Cl- | D�� | CH3COOH?CH3COO-+H+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com