
【题目】已知有以下物质相互转化:
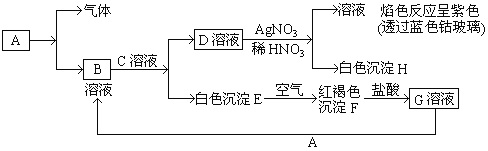
试回答
(1)写出C的化学式____________;
(2)A与水蒸气反应方程式为:__________________________ ;
(3)写出由E转变成F的化学方程式_______________________;
(4)鉴别G溶液中阳离子的方法是:____________________,现象为:________;用G溶液可以腐蚀铜印刷电路板,离子反应方程式为___________________________;
(5)金属铝与A的氧化物可用来焊接火车铁轨,实验室中该反应所需药品有_____________。
【答案】KOH 3Fe+4H2O(g) ![]() Fe3O4+4H2 4Fe(OH)2+O2+2H2O=4Fe(OH)3 取少量G溶液于试管中滴加KSCN溶液 溶液呈红色 2Fe3++Cu=2Fe2++Cu2+ 铝和氧化铁的混合物、氯酸钾和镁条
Fe3O4+4H2 4Fe(OH)2+O2+2H2O=4Fe(OH)3 取少量G溶液于试管中滴加KSCN溶液 溶液呈红色 2Fe3++Cu=2Fe2++Cu2+ 铝和氧化铁的混合物、氯酸钾和镁条
【解析】
通过D与硝酸银反应产物的性质和现象可知D为KCl,红色沉淀F为4Fe(OH)3,则E为Fe(OH)2,G为FeCl3,由此可知A为Fe,B为FeCl2,C应为KOH,结合对应物质的性质和题目要求可解答该题。
根据上述推断可知A是Fe,B是FeCl2,C为KOH,D为KCl,E为Fe(OH)2,F为4Fe(OH)3,G为FeCl3,H为AgCl。
(1)根据上述分析可知C是KOH;
(2) A是Fe,Fe与水蒸气在高温下反应产生Fe3O4和H2,反应方程式为3Fe+4H2O(g) ![]() Fe3O4+4H2;
Fe3O4+4H2;
(3) Fe(OH)2不稳定,在空气中容易被空气中的氧气氧化为Fe(OH)3,由E转变成F的化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(4)G为FeCl3,其阳离子为Fe3+,鉴别G溶液中阳离子Fe3+的方法是取少量G溶液于试管中滴加KSCN溶液,若溶液变为血红色,就证明含有Fe3+;Fe3+具有强的氧化性,可以与Cu发生氧化还原反应,离子反应方程式为2Fe3++Cu=2Fe2++Cu2+,一次工业上用FeCl3溶液来腐蚀铜印刷电路板;
(5)由于Al的活动性强,可以把金属从其氧化物置换出来,所以金属铝与铁的氧化物在高温下发生铝热反应置换的铁用来焊接火车铁轨。实验室中该反应所需药品有氧化剂氯酸钾、引燃剂镁条、铝粉和活动性比铝弱的金属铁的氧化物—氧化铁。


科目:高中化学 来源: 题型:
【题目】在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示,下列分析正确的是
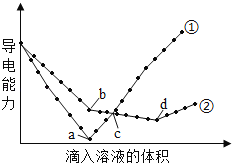
A. ②代表滴加H2SO4溶液的变化曲线
B. b点,两反应物物质的量之比为1: 2
C. a、d两点对应的溶液均显中性
D. c点,两溶液中含有相同物质的量浓度的OH﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列所配溶液浓度为1mol/L的是( )
A. 将31g Na2O溶于1L水中 B. 常温下,将22.4LHCl溶于水中,配成1L溶液
C. 将100mL5mol/L的KNO3溶液加水称释至500mL D. 将10mL10mol/L的H2SO4溶液与90mL水混合
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D都是中学化学中常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转换关系 (部分反应中得水已忽略)

(1)若A为氯碱工业的产品,C为厨房中的用品。
①反应Ⅰ的离子方程式为____________________________________________;
②氯碱工业制备A的化学方程式是__________________________________________________。
(2)若A、D均为单质,且A为气体,D元素的一种红棕色氧化物常用作颜料。
①B溶液可净水的原因是____________________________________________;
②A的实验制法的化学方程式____________________________________________。
(3)若B是一种两性氢氧化物,请写出反应Ⅲ的离子方程式____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E、F 六种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示。E的单质可与酸反应,1molE单质与足量酸作用,在标准状况下能产生33.6 L H2,E的阳离子与A的阴离子核外电子层结构完全相同,F原子半径在短周期元素中最大,回答下列问题:
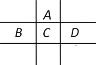
(1)元素的名称:B_____________;
(2)画出C离子的结构示意图:______________;
(3)写出D元素在周期表中的位置:__________;D元素的单质可用于制漂白液和漂白粉,写出制漂白液的离子方程式:____________,漂白粉的有效成分是______________;
(4)B的同族上一周期元素的氢化物为__________(化学式) ,实验室制取该物质的方程式为_________,制取该气体时用______________做干燥剂。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.124 g P4含有P—P键的个数为4NA
B.12 g石墨烯(单层石墨)中含有C-C键的数目为3NA
C.60gSiO2中含Si—O键的个数为2NA
D. 六方最密堆积的配位数是12,空间利用率是74%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是:( )
①Cl-的结构示意图
②羟基的电子式:![]()
③HClO的结构式:H—Cl—O
④NaHCO3在水中的电离方程式:NaHCO3=Na++H++CO32-
⑤Na2O的水溶液能导电,这不能说明Na2O是电解质
⑥SiO2既能与氢氟酸反应又能与NaOH溶液反应,故SiO2是两性氧化物;
⑦分馏、干馏、裂化都是化学变化( )
A. ①②⑤ B. ①④⑥⑦ C. ②③④⑥ D. ②③⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝和氢氧化钾都是重要的工业产品。请回答下列问题:
(1)工业冶炼铝的化学方程式是_________________。阴极反应式:__________。
若阳极转移电子0.6 mol生成Al的质量是________ g。
(2)铝与氢氧化钾溶液反应的离子方程式是_____________________________。
(3)工业产品氢氧化钾的溶液中含有某些含氧酸根离子,可用离子交换膜法电解提纯。电解槽内装有阳离子交换膜(只允许阳离子通过),工作原理如下图所示。
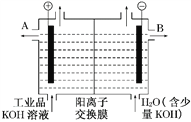
①该电解槽的阳极反应是__________________。
②通电开始后,阴极附近溶液pH会增大,原因为___________________________
③除去杂质后的氢氧化钾溶液从液体出口________(填“A”或“B”)导出。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列有关物质的用途叙述错误的是( )
A.Ca(ClO)2用于消毒杀菌B.用铝制容器盛装稀硫酸
C.Fe2O3用于炼铁D.氧化镁作耐火材料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com