
����Ŀ�����������һ����ֲ���͡������ͻ������֬��Ϊԭ�ϼӹ����ɵ����ȼ������Ҫ�ɷ�Ϊ��֬���������һ���ò����͵�Ϊԭ���Ʊ�������͵�ʵ�鲽�����£�
������ͼ��ʾ��������ƿ�м���3.2 g CH3OH��0.2 g NaOH���ܽ�������м���20 g(0.021��0.023 mol)�����ͼ�60 mL�����顣

��������60��65 �棬����2.5��3 h�����á��ϲ�Ϊ������͡������鼰�״����²���ҪΪ���͡�
����Һ��ˮϴ��
������������120��ʱ����Һ��������ʣ����Ϊ������͡�
��1��������п���n(CH3OH)/n(��֬)��3��Ŀ����________���������������________��
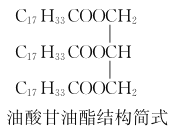
��2����������˵ļ��ȷ�ʽ��________�������͵ijɷ�֮һ���������(�ṹ��ʽ����ͼ)��״���Ӧ�Ļ�ѧ����ʽΪ________________________________________________��
��3��������÷�Һ©������ʱ����ȡ�ϲ�Һ��ķ�����________����ˮϴ���ϲ�Һ��ʱ��˵����ϴ�Ӹɾ���������__________________________________��
���𰸡� ���������ʱ��֬��ת���� �ܼ� ˮԡ���� 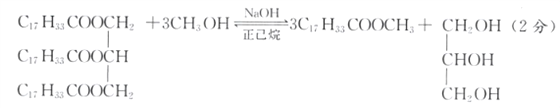 �ȷ�����²�Һ��Ȼ��رջ������ӷ�Һ©���Ͽڵ����ϲ�Һ�� ��pH��ֽ������ˮ�������
�ȷ�����²�Һ��Ȼ��رջ������ӷ�Һ©���Ͽڵ����ϲ�Һ�� ��pH��ֽ������ˮ�������
��������(1)�����������������Ҫ�ɷ�Ϊ��֬��������������͵���Ҫ�ɷ�Ϊ��֬��������������Լ���״���NaOH�������鹲ͬ�����£�������������Ӧ���������Ӧ��CH3OH�������������֬��ת���ʣ�������������Ϊ�ܼ����ܽ�����ʹٽ���Ӧ���У�
(2) �����¶�Ϊ60~65�����������˵ļ��ȷ�����ˮԡ�������������״���Ӧ�Ļ�ѧ����ʽΪ ��
��
(3) �÷�Һ©����Һʱ����ȡ�ϲ�Һ��ķ������ȷ�����²�Һ��Ȼ��رջ������ӷ�Һ©���Ͽڵ����ϲ�Һ�����ϲ�Һ��Ϊ������͡������鼰�״������ܺ���������NaOH��Һ����ˮϴ��ʱ������pH��ֽ���飬ˮ������ʱ��������ϴ�Ӹɾ���


 ������Ӧ�������������ϵ�д�
������Ӧ�������������ϵ�д� �㽭֮�ǿ�ʱ�Ż���ҵϵ�д�
�㽭֮�ǿ�ʱ�Ż���ҵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪X��Y��Ϊ1��18��֮���Ԫ�أ�X��Y���γɻ�����X2Y��X2Y2 �� ��֪Y��ԭ������С��X��ԭ��������������Ԫ�ص�ԭ������֮��Ϊ�� ��
A.19
B.18
C.27
D.9
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������װ�õ�˵����ȷ������ ��
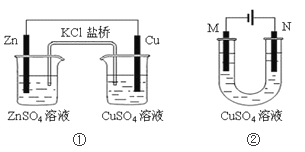
A. װ�â��������ڵ�K+����ZnSO4��Һ
B. ��װ��������������ͭ����M��Ϊ����
C. ��װ������N��Ϊ������M��Ϊʯī�����������ױ���ʴ
D. ��װ�â����ڵ�⾫��ͭ������Һ��Cu2+Ũ�ȱ��ֲ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͬ�����͵�������������ijЩ��ͬ�����ʣ����������в��������ͨ�Ե��ǣ� ��
A.��Ӧ�����κ�ˮ
B.ʹ��ɫʯ����Һ����ɫ
C.����ý�����Ӧ�����κ�����
D.�������Ʒ�Ӧ�����κ�ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Ρ����Ӽ������������HPF�����Һ�е���Ҫ��Ⱦ��(���л�����Cl����SO![]() ��Na����)������NaClO3��H2SO4���ѳ����Լ���
��Na����)������NaClO3��H2SO4���ѳ����Լ���
��1��Cl2���ȵ�NaOH��Һ��Ӧ����NaClO3���÷�Ӧ�Ļ�ѧ����ʽΪ____________________________��
��2�� ����ʱ����ӦC6H5O����H2O ![]() C6H5OH��OH����ƽ�ⳣ��ΪK��________(C6H5OH��Ka��1��10��10)��
C6H5OH��OH����ƽ�ⳣ��ΪK��________(C6H5OH��Ka��1��10��10)��
��3�������÷�ˮ�辭Ԥ�������ٴ����Ρ�
����Ũ�����600 mL HPF�����Һ�����ữԤ����(��Ӧ�¶�100��)���������1��ʾ��
��1��Ԥ����ǰ����������Ũ�ȱ仯���
��Ŀ | S2O | SCN��(g��L��1) | ����(g��L��1) | pH |
����ǰ | 34.28 | 70.11 | 1.3 | 8.55 |
������ | 0.91 | 69.76 | 1.35 | 2.4 |
�ɱ�1��֪���ô�����������Ҫ����ȥ����Ⱦ����________��
����Ԥ�������Һ�����ٴ���(��Ӧ�¶�100 ��)ʱ��13���������Һ�м����Լ�������2��ʾ��
��2��13�����μ����Լ����
���� | 1 | 2 | 3 | 4 | span>5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
NaClO3/g | 16.3 | 0 | 0 | 0 | 0 | 0 | 7.6 | 0 | 5.7 | 0 | 10.9 | 0 | 7.1 |
ŨH2SO4/mL | 0 | 2 | 2 | 2 | 4 | 4 | 0 | 4 | 0 | 4 | 0 | 4 | 0 |
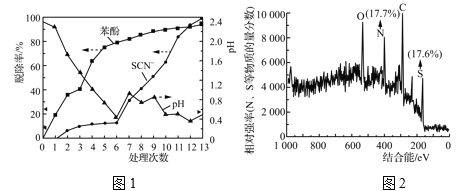
ʵ������ͼ1��ʾ��
ǰ![]() ��Cl����Ӧ����Cl2�йء��ð�ɫ�������ܵĽṹ��ʽΪ______________��
��Cl����Ӧ����Cl2�йء��ð�ɫ�������ܵĽṹ��ʽΪ______________��
���ɱ�2��ͼ1�����ݵó�����7��13�β�����SCN���ڽ�ǿ���������±�ClO![]() (��ˮ��)������������________���˹����в�������ש��ɫ����(����������ɫ����)���Գ�������XPS����������Ԫ�ص����ʵ���������ͼ2��ʾ����֪SCN���ɱ�ijЩ������(��Cu2����)��������Ϊש��ɫ�ij���(SCN)x��һ���Ʋ���Ϊ��ʵ���в�����ש��ɫ����Ϊ(SCN)x��֧�ָ��Ʋ��֤���У�________��
(��ˮ��)������������________���˹����в�������ש��ɫ����(����������ɫ����)���Գ�������XPS����������Ԫ�ص����ʵ���������ͼ2��ʾ����֪SCN���ɱ�ijЩ������(��Cu2����)��������Ϊש��ɫ�ij���(SCN)x��һ���Ʋ���Ϊ��ʵ���в�����ש��ɫ����Ϊ(SCN)x��֧�ָ��Ʋ��֤���У�________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������[CO(NH2)2]��һ�ַdz���Ҫ�ĸ�Ч���ʣ���ҵ����NH3��CO2Ϊԭ���������أ��÷�Ӧʵ��Ϊ������Ӧ��
��һ����2NH3(g)��CO2(g)===H2NCOONH4(s) ��H=��272kJ��mol��1
�ڶ�����H2NCOONH4(s)===CO(NH2)2(s)��H2O(g) ��H=��138kJ��mol��1
��1��д����ҵ����NH3��CO2Ϊԭ�Ϻϳ����ص��Ȼ�ѧ����ʽ��_________________________
��2��ijʵ��С��ģ�ҵ�Ϻϳ����ص���������һ���Ϊ0.5 L�ܱ�������Ͷ��4 mol����1mol������̼��ʵ���÷�Ӧ�и���ֵ����ʵ�����ʱ��ı仯����ͼ��ʾ��
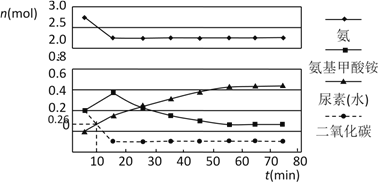
��֪�ܷ�Ӧ�Ŀ���������һ����������ϳ������ܷ�Ӧ�Ŀ����ɵ�_________����Ӧ�������ܷ�Ӧ���е�_________minʱ����ƽ�⡣
��3���������[CO(NH2)2]�ļ�����Һ�ƴ��������Ĺ�����ͬʱ�������������ʱ�������ĵ缫��ӦʽΪ________________________________��
���ý�̿��ԭNO2�ķ�ӦΪ��2NO2(g)+2C(s )![]() N2(g)+2CO2(g)���ں��������£�1 mol NO2������C�����÷�Ӧ�����ƽ��ʱNO2��CO2�����ʵ���Ũ����ƽ����ѹ�Ĺ�ϵ��ͼ��ʾ��
N2(g)+2CO2(g)���ں��������£�1 mol NO2������C�����÷�Ӧ�����ƽ��ʱNO2��CO2�����ʵ���Ũ����ƽ����ѹ�Ĺ�ϵ��ͼ��ʾ��
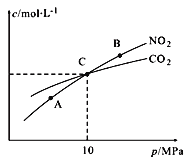
��A��B�����Ũ��ƽ�ⳣ����ϵ��Kc(A)_______Kc(B) ���� ����������<����������
�ڼ���C��ʱ�÷�Ӧ��ѹǿƽ�ⳣ��Kp(C)=______��Kp����ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ����ѹ�����ʵ�����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij������A������ת����ϵ��
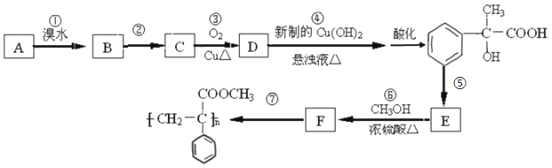
��1��д����Ӧ�ں͢ݵķ�Ӧ��������______________����_______________.
��2��д��A�Ľṹ��ʽ��____________________��
��3��д����Ӧ���Ļ�ѧ����ʽ��________________________________________.
��4����Ӧ�۵ķ�Ӧ����_________________.
��5��������ѧ֪ʶ�ͻ�ȡ����Ϣ��д����CH3COOH��![]() Ϊԭ�Ϻϳ���Ҫ�Ļ�����Ʒ
Ϊԭ�Ϻϳ���Ҫ�Ļ�����Ʒ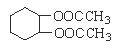 ��·������ͼ�����Լ���ѡ�� �ϳ�·������ͼʾ�����£�
��·������ͼ�����Լ���ѡ�� �ϳ�·������ͼʾ�����£�

_________________________________________________________________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��������Һ���������ӵ�Ũ�����±���ʾ����M����Ϊ��������
���� | NO3�� | SO42�� | H+ | M |
Ũ��/(mol/L) | 2 | 1 | 2 | 2 |
A.Cl��B.Ba2+C.Na+D.Mg2+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͨ�����з�ɢϵʱ���ܹ۲쵽�����ЧӦ����
A.KCl��ҺB.Fe(OH)3����C.KOH��ҺD.Na2SO4��Һ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com