
【题目】在3个体积均为2.0L的恒容密闭容器中,反应CO2(g)+C(s)![]() 2CO(g) H>0分别在一定温度下达到化学平衡状态。下列说法正确的是( )
2CO(g) H>0分别在一定温度下达到化学平衡状态。下列说法正确的是( )
容器 | 温度/K | 起始时物质的量/mol | 平衡时物质的量/mol | ||
n(CO2) | n(C) | n(CO) | n(CO) | ||
Ⅰ | 977 | 0.28 | 0.56 | 0 | 0.4 |
Ⅱ | 977 | 0.56 | 0.56 | 0 | x |
Ⅲ | 1250 | 0 | 0 | 0.56 | y |
A.达到平衡时,向容器Ⅰ中增加C(s)的量,平衡正向移动
B.x=0.8,y>0.4
C.达到平衡时,容器Ⅲ中的CO的转化率小于![]()
D.若起始时向容器Ⅱ中充入0.1molCO2、0.2molCO和足量的C(s),则反应将向正反应方向进行
【答案】CD
【解析】
A.达到平衡时,向容器Ⅰ中增加C(s)的量,由于CO2(g)、CO(g)的浓度都不发生变化,所以平衡不发生移动,A不正确;
B.容器Ⅱ相当于容器Ⅰ减小体积为1L,此时平衡逆向移动,x<0.8,B不正确;
C.若容器Ⅲ中温度也为977K,与容器Ⅰ为等效平衡,达到平衡时,y=0.4,容器Ⅲ中的CO的转化率为![]() =
=![]() ,现容器Ⅲ中温度为1250K,相当于977K时的平衡体系升高温度,平衡正向移动,CO的转化率减小,所以容器Ⅲ中的CO的转化率小于
,现容器Ⅲ中温度为1250K,相当于977K时的平衡体系升高温度,平衡正向移动,CO的转化率减小,所以容器Ⅲ中的CO的转化率小于![]() ,C正确;
,C正确;
D.在容器Ⅰ中,K= =1,若起始时向容器Ⅱ中充入0.1molCO2、0.2molCO和足量的C(s),此时浓度商Q=
=1,若起始时向容器Ⅱ中充入0.1molCO2、0.2molCO和足量的C(s),此时浓度商Q=![]() =0.2<1,所以平衡将向正反应方向进行,D正确;
=0.2<1,所以平衡将向正反应方向进行,D正确;
故选CD。


科目:高中化学 来源: 题型:
【题目】H3BO3(一元弱酸)可以通过电解NaB(OH)4溶液的方法制备,其工作原理如图,下列叙述错误的是( )
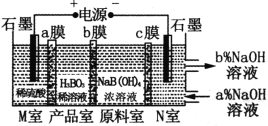
A.M室发生的电极反应式为:2H2O-4e-=O2↑+4H+
B.b膜为阴膜,产品室发生反应的化学原理为强酸制弱酸
C.理论上每生成1 mol产品,阴极室可生成标准状况下5.6 L气体
D.N室中:a%<b%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述错误的是
A.生铁中含有碳,抗腐蚀能力比纯铁弱
B.下图为埋在地下的钢管道采用牺牲阳极保护法防腐
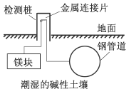
C.金属在一般情况下发生的电化学腐蚀主要是吸氧腐蚀
D.马口铁(镀锡铁)镀层破损后,被腐蚀时首先是镀层被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酰丙酮铜是金属有机化合物中一种重要的化合物,广泛应用于化工、石油、制药、电子、材料、机械等领域。实验室制备原理如下:
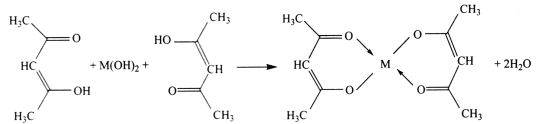
实验步骤:
(1)制取氢氧化铜(II)
分别称取4.000g(0.1mol)氢氧化钠、8.000g(0.05mol)无水硫酸铜于250mL、100mL烧杯中,加入适量的蒸馏水使其溶解,然后将硫酸铜溶液倒入氢氧化钠溶液中,摇匀,使反应完全,再将沉淀进行抽滤。
(2)制备乙酰丙酮铜(II)
称取0.1960g(2mmol)新制的氢氧化铜于100mL仪器a中,在氮气保护下加入少量的四氢呋喃,并进行搅拌,约五分钟之后,加入0.4000g(4mmol)乙酰丙酮,补充四氢呋喃约30mL,在50℃下加热回流约2h,然后冷却至室温,转移到锥形瓶中,用薄膜封口,放置4~5天,得到蓝色针状晶体。
已知:
I.氢氧化铜(II)分解温度为60℃。
II.四氢呋喃易挥发,沸点66℃,储存时应隔绝空气,否则易被氧化成过氧化物。
III.乙酰丙酮铜(II)是一种蓝色针状晶体,难溶于水,微溶于乙醇,易溶于苯、氯仿、四氯化碳。66.66kPa压力下,78℃升华。
回答下列问题:
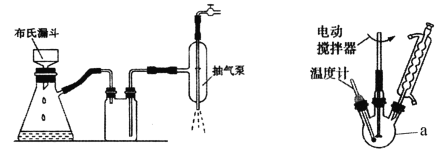
(1)制取氢氧化铜(II)时采用抽滤的方式进行,已知抽滤装置如图所示,抽滤与常规过滤相比其优点是____________________。
(2)制备乙酰丙酮铜(II)时采用氮气保护的目的________________,加入四氢呋喃的作用是__________________。
(3)加热回流简易装置如图(加热部分省略)所示,仪器a的名称是_______________,加热回流时采用球形冷凝管而不选用直形冷凝管的原因是________________。加热方式宜采用_______________。在50℃下加热回流的原因除防止四氢呋喃挥发外,还有可能的原因是_____________(用化学方程式表示)。
(4)若要纯化乙酰丙酮铜晶体,可以采用的实验方法是___________。若纯化后蓝色针状晶体的质量为0.3630g(乙酰丙酮铜的相对分子质量为262),则产率为________%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,根据表中给出的10种元素,按要求作答
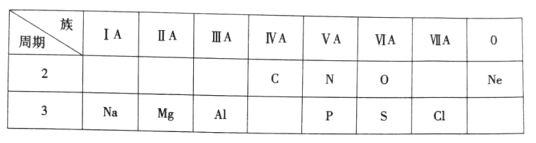
(1)镁元素位于元素周期表中第___周期_____族;
(2)空气组成中体积分数最大的气体是_____;
(3)O与S相比,原子半径较小的是____;
(4)金刚石的组成元素是________;
(5)单质的化学性质最不活泼的元素是______;
(6)Na与Mg元素相比金属性较强的是_________
(7)NH3与PH3相比,热稳定性较弱的是______
(8)H2SO4与H3PO4相比酸性较强的是______
(9)Mg(OH)2与Al(OH)3其中属于两性氢氧化物的是________
(10)单质呈黄绿色的气体组成元素是_____,其单质的水溶液呈__(填“酸性或“碱性”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用![]() 、
、![]() 可以制备含有
可以制备含有![]() 的
的![]() 悬浊液,该悬浊液可用于检验醛基,也可用于和葡萄糖反应制备纳米
悬浊液,该悬浊液可用于检验醛基,也可用于和葡萄糖反应制备纳米![]() 。
。
(1)基态![]() 的核外电子排布式为__________。
的核外电子排布式为__________。
(2)与![]() 互为等电子体的一种分子为________(填化学式)。
互为等电子体的一种分子为________(填化学式)。
(3)![]() 与
与![]() 反应能生成
反应能生成![]() ,
,![]() 中的配位原子为________(填元素符号)。
中的配位原子为________(填元素符号)。
(4)乙醛(![]() )中碳原子的轨道杂化类型是_________;
)中碳原子的轨道杂化类型是_________;![]() 中含有
中含有![]() 键的数目为________
键的数目为________![]() 。
。
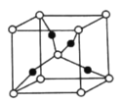
(5)一个![]() 晶胞(见图)中,
晶胞(见图)中,![]() 原子的数目为________。
原子的数目为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
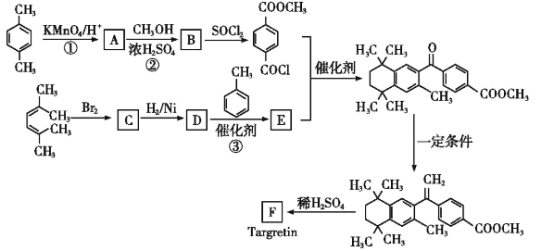
【题目】药物Targretin(F)能治疗顽固性皮肤T细胞淋巴瘤,其合成路线如图所示:
已知:
ⅰ.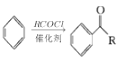
ⅱ.![]()
ⅲ.RCOOH![]() RCOCl(R表示烃基)
RCOCl(R表示烃基)
(1)反应①的反应类型是__。
(2)反应②的化学方程式:__。
(3)C的核磁共振氢谱图中有__个峰。
(4)反应③的化学方程式:__。
(5)F的分子式是C24H28O2。F中含有的官能团:__。
(6)写出满足下列条件A的两种同分异构体的结构简式(不考虑-O-O-或![]() 结构):__。
结构):__。
a.苯环上的一氯代物有两种
b.既能发生银镜反应又能发生水解反应
(7)已知:![]() (R、R′为烃基)。以2-溴丙烷和乙烯为原料,选用必要的无机试剂合成
(R、R′为烃基)。以2-溴丙烷和乙烯为原料,选用必要的无机试剂合成![]() ,写出合成路线__(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件。
,写出合成路线__(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钛(Ti)被誉为21世纪金属,其单质和化合物具有广泛的应用价值。
(1)在基态Ti原子中,核外存在_____对自旋相反的电子,核外电子占据最高能层的符号是___,占据该能层电子的电子云轮廓图形状为____。
(2)TiCl3 可用作烯烃定向聚合的催化剂,例如丙烯用三乙基铝和三氯化钛做催化剂时,可以发生下列聚合反应:nCH3CH=CH2 ![]()
![]() ,该反应中涉及的物质中碳原子的杂化轨道类型有_______;反应中涉及的元素中电负性最大的是______。 三乙基铝是一种易燃物质,在氧气中三乙基铝完全燃烧所得产物中分子的立体构型是直线形的是__________。
,该反应中涉及的物质中碳原子的杂化轨道类型有_______;反应中涉及的元素中电负性最大的是______。 三乙基铝是一种易燃物质,在氧气中三乙基铝完全燃烧所得产物中分子的立体构型是直线形的是__________。
(3)[TiO(H2O2)2]2+配离子呈黄色。提供中心原子孤电子对的成键原子是_____(填元素符号);配体之一H2O2分子中氧原子的价层电子对互斥模型是___。
(4)科学家通过X射线探明一种氮化钛的晶体与NaCl的晶体结构相似。氮化钛熔点(2950℃)比氯化钠的高,主要原因是________________。
(5)有一种氮化钛晶体的晶胞如图所示,该晶体中Ti原子周围与Ti原子距离最近且相等的N原子的个数为_____。已知晶体的密度为ρ g·cm-3,阿伏加德罗常数为NA,则晶胞边长为____cm(用含ρ、NA的式子表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na3OCl是一种良好的离子导体,具有反钙钛矿晶体结构。回答下列问题:
(1)基态Ti原子4s轨道上的一个电子激发到4p轨道上形成激发态,写出该激发态价层电子排布式_____________
(2)锌和镉位于同副族,而锌与铜相邻。现有4种铜、锌元素的相应状态:①锌:[Ar]3d104s2、②锌:[Ar]3d104s1、③铜:[Ar]3d104s1、④铜:[Ar]3d10。失去1个电子需要的能量由大到小排序是_________(填字母)。
A.④②①③ B.④②③① C.①②④③ D.①④③②
(3)由O、Cl元素可组成不同的单质和化合物,其中Cl2O2能破坏臭氧层。
①Cl2O2的沸点比H2O2低,原因是____。
②O3分子的中心原子杂化类型为______;与O3互为等电子体的是______(任意写一种)。
(4)Na3OCl可由以下方法制得:2Na+2NaOH+2NaCl 2Na3OCl+H2↑,在该反应中,形成的化学键有_____(填标号)。
2Na3OCl+H2↑,在该反应中,形成的化学键有_____(填标号)。
A.金属键 B.离子键 C.配位键 D.极性键 E.非极性键
(5)Na3OCl晶体属于立方晶系,其晶胞结构如图所示。已知:晶胞参数为anm,密度为dg·cm3。
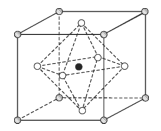
①Na3OCl晶胞中,O位于各顶点位置,Cl位于______位置。
②用a、d表示阿伏加德罗常数的值NA=_____(列计算式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com