
【题目】某无色透明溶液中可能大量存在![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的几种离子。从其中取100mL,等分成两份进行如下实验:
中的几种离子。从其中取100mL,等分成两份进行如下实验:
(1)不做任何实验就可以肯定原溶液中不存在的两种离子,其氧化性______![]() ______
______![]() 填写离子符号
填写离子符号![]() ,能说明上述结论的离子方程式是______。
,能说明上述结论的离子方程式是______。
(2)取其中的一份进行实验,加入过量氢氧化钠溶液并加热,生成气体![]() 。取其中的一份加入过量
。取其中的一份加入过量![]() ,生成白色沉淀
,生成白色沉淀![]() ,过滤,向沉淀中再加入过量稀盐酸,沉淀部分消失,余下沉淀2.33g。说明原溶液中肯定有的离子是______,沉淀溶解的离子反应式为______。
,过滤,向沉淀中再加入过量稀盐酸,沉淀部分消失,余下沉淀2.33g。说明原溶液中肯定有的离子是______,沉淀溶解的离子反应式为______。
(3)综上可知溶液中必定还存在______,且浓度范围为______。
(4)溶液中还可能存在的阳离子有______,检验的操作为______。
【答案】![]()
![]()
![]()
![]() 、
、![]()
![]()
![]()
![]()
![]() 用铂丝或光洁无锈的铁丝蘸取试液,在酒精灯火焰上灼烧,观察焰色
用铂丝或光洁无锈的铁丝蘸取试液,在酒精灯火焰上灼烧,观察焰色
【解析】
(1)无色透明溶液中不能大量存在有色离子:![]() 、
、![]() ,其氧化性
,其氧化性![]() ,在氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性,根据反应:
,在氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性,根据反应:![]() 可以证明,故答案为:
可以证明,故答案为:![]() 、
、![]() ,
,![]() ;
;
(2)取其中的一份进行实验,加入过量氢氧化钠溶液并加热,生成气体![]() ,即为氨气,一定含有
,即为氨气,一定含有![]() ,取其中的一份加入过量
,取其中的一份加入过量![]() ,生成白色沉淀
,生成白色沉淀![]() ,过滤,向沉淀中再加入过量稀盐酸,沉淀部分消失,余下沉淀
,过滤,向沉淀中再加入过量稀盐酸,沉淀部分消失,余下沉淀![]() ,则一定含有
,则一定含有![]() 、
、![]() ,碳酸钡溶于盐酸
,碳酸钡溶于盐酸![]() ,但是硫酸钡不溶,故答案为:
,但是硫酸钡不溶,故答案为:![]() 、
、![]() ;
;![]() ;
;
(3)生成气体![]() ,即为氨气,一定含有
,即为氨气,一定含有![]() ,生成白色沉淀
,生成白色沉淀![]() ,是碳酸钡和硫酸钡的混合物,一定含有
,是碳酸钡和硫酸钡的混合物,一定含有![]() 、
、![]() ,余下沉淀
,余下沉淀![]() 是硫酸钡,物质的量是
是硫酸钡,物质的量是![]() ,所以含有硫酸根离子是
,所以含有硫酸根离子是![]() ,碳酸钡是
,碳酸钡是![]() ,碳酸根的物质的量是
,碳酸根的物质的量是![]() ,一定不含
,一定不含![]() 、
、![]() 、
、![]() ,根据电荷守恒可知溶液中必定还存在
,根据电荷守恒可知溶液中必定还存在![]() ,由于钠离子不能确定,则硝酸根离子的物质的量
,由于钠离子不能确定,则硝酸根离子的物质的量![]() ,浓度
,浓度![]() ,故答案为:
,故答案为:![]() ,
,![]() ;
;
(4)溶液中还可能存在的阳离子有![]() ;检验方法:用铂丝或光洁无锈的铁丝蘸取试液,在酒精灯火焰上灼烧,观察焰色,故答案为:
;检验方法:用铂丝或光洁无锈的铁丝蘸取试液,在酒精灯火焰上灼烧,观察焰色,故答案为:![]() ;用铂丝或光洁无锈的铁丝蘸取试液,在酒精灯火焰上灼烧,观察焰色。
;用铂丝或光洁无锈的铁丝蘸取试液,在酒精灯火焰上灼烧,观察焰色。


科目:高中化学 来源: 题型:
【题目】FeCl2是一种常用的还原剂、媒染剂。某化学实验小组在实验室里用如下两种方法来制备无水FeCl2。有关物质的性质如下:
| C6H5Cl(氯苯) | C6H4Cl2(二氯苯) | FeCl3 | FeCl2 |
溶解性 | 不溶于水,易溶于苯、乙醇 | 不溶于C6H5Cl、C6H4Cl2、苯, 易溶于乙醇,易吸水 | ||
熔点/℃ | -45 | 53 | 易升华 | |
沸点/℃ | 132 | 173 | ||
(1)用H2还原无水FeCl3制取FeCl2。有关装置如下:

①H2还原无水FeCl3制取FeCl2的化学方程式为_____________。
②按气流由左到右的方向,上述仪器的连接顺序为_________(填字母,装置可多次使用);C中盛放的试剂是_____________。
③该制备装置的缺点为________________。
(2)利用反应2FeCl3+C6H5Cl→2FeCl2+C6H4Cl2+HCl↑,制取无水FeCl2并测定FeCl3的转化率。按下图装置,在三颈烧瓶中放入32.5g无水氯化铁和过量的氯苯,控制反应温度在一定范围加热3h,冷却、分离提纯得到粗产品。

①仪器a的名称是__________。
②反应结束后,冷却实验装置A,将三颈烧瓶内物质倒出,经过滤、洗涤、干燥后,得到粗产品。洗涤所用的试剂可以是____,回收滤液中C6H5C1的操作方法是______。
③反应后将锥形瓶中溶液配成250mL,量取25.00mL所配溶液,用0.40mol/LNaOH溶液滴定,终点时消耗NaOH溶液为19.60 mL,则氯化铁的转化率为__________。
④为了减少实验误差,在制取无水FeCl2过程中应采取的措施有:________(写出一点即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是( )
A.1molH2SO4与1 molBa(OH)2反应生成H2O时放出的热叫做中和热
B.△H>0kJmol-1表示放热反应,![]() <0kJmol-1表示吸热反应
<0kJmol-1表示吸热反应
C.热化学方程式中的化学计量数表示物质的量,可以是分数
D.1molH2与0.5molO2反应放出的热就是H2的燃烧热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1-溴丙烷是一种重要的有机合成中间体。实验室制备少量1-溴丙烷的主要步骤如下:
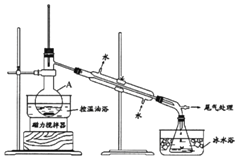
步骤1:在仪器A中加入搅拌磁子、12g 1-丙醇及20mL水,在冰水冷却下缓慢加入28mL浓H2SO4;冷却至室温,搅拌下加入24g NaBr。
步骤2:缓慢加热,直到无油状物馏出为止。
步骤3:将馏出液转入分液漏斗,分离出有机相。
步骤4:将分离出的有机相转入分液漏斗,依次用H2O、5%的Na2CO3溶液洗涤,分液,得粗产品,进一步提纯得1-溴丙烷。
已知:①1-溴丙烷沸点为71℃,密度为1.36g/cm3;
②反应过程中,在仪器A中可以观察到A的上方出现红棕色蒸气(Br2)。
回答下列问题:
(1)仪器A的名称是______;加入搅拌磁子的目的是搅拌和______。
(2)仪器A中主要发生反应为:NaBr + H2SO4===HBr + NaHSO4和______。
(3)步骤2中需向接收瓶内加入少量冰水并置于冰水浴中的目的是______,同时可以观察到的现象是______。
(4)步骤4中的两次洗涤,依次洗去的主要杂质是______、_________。
(5)步骤4中的Na2CO3溶液还可以用下列中的______试剂代替。
A.NaOH溶液 B.NaI溶液 C.Na2SO3溶液 D.CCl4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】幸福可以“人工合成”吗?精神病学专家通过实验发现,人体中的一种脑内分泌物多巴胺,可影响一个人的情绪。多巴胺是一种神经递质,用来帮助细胞传送脉冲的化学物质。这种脑内分泌物主要负责大脑的情感,将兴奋及开心的信息传递,使人感到愉悦和快乐。多巴胺可由香兰素与硝基甲烷缩合,再经锌还原水解而得,合成过程如下:
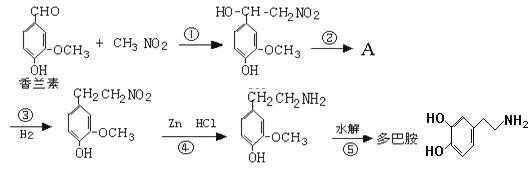
请回答下列问题:
(1)写出香兰素中含有的官能团的名称是___________________。
(2)上述合成过程中属于加成反应的是 (填反应序号)_____________。
(3)反应②的反应条件是__________。有机物A的结构简式为____________。
(4)写出符合下列条件的多巴胺的所有同分异构体的结构简式:_______________。
(i)属于1,3,5-三取代苯 (ii)苯环上直接连有一个羟基和一个氨基
(iii)分别能与钠和氢氧化钠反应,消耗钠与氢氧化钠的物质的量之比为2∶1
(5)多巴胺遇足量浓溴水会产生沉淀,请写出该反应的化学方程式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,发生可逆反应A(s)+2B(g)![]() 2C(g)+D(g) △H<0。现将1 mol A和2 mol B加入甲容器中,将4 molC和2 molD加入乙容器中。起始时,两容器中的压强相等,t1时两容器内均达到平衡状态(如图所示,隔板K固定不动)。下列说法正确的是( )
2C(g)+D(g) △H<0。现将1 mol A和2 mol B加入甲容器中,将4 molC和2 molD加入乙容器中。起始时,两容器中的压强相等,t1时两容器内均达到平衡状态(如图所示,隔板K固定不动)。下列说法正确的是( )

A.向甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度与乙中C的浓度相等
B.t1时,甲、乙两容器中的压强仍相等
C.移动活塞P,使乙的容积和甲的相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍
D.分别向甲、乙中加入等量的氦气,甲中反应速率和乙中的反应速率均不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用图装置(气密性好)研究钠与氯气的反应。

实验步骤:
①将一定量浓盐酸滴在KMnO4粉末上,立即产生黄绿色气体。
②待黄绿色气体均匀充满集气瓶时,关闭止水夹。
③再向钠粒上滴2滴水,片刻后钠燃烧,产生白烟,白色固体附着在集气瓶内壁上。
(1)步骤①,黄绿色气体是氯气,则KMnO4的作用是__________(填“氧化剂”或“还原剂”)。
(2)步骤③,引起钠燃烧的原因是____________。
(3)生成白色固体的化学方程式是______________。
(4)结合离子方程式说明NaOH溶液的作用是_______________。
(5)实验结束后,甲同学在安全、环保的理念指导下,仅用上图装置就完成了集气瓶内残余氯气的处理,其操作是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D、E五种有机物,它们有如下相互转化关系:
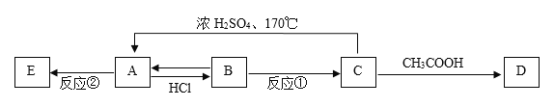
已知:A是相对分子质量为28的烃,E属于高分子化合物。请完成下列各题:
(1)物质A的名称是______________,物质D的结构简式为____________________。
(2)写出反应①的化学方程式:_______,该反应属于_____________反应。
(3)写出反应②的化学方程式:______________,该反应属于_____________反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组的同学用下图所示装置研究有关电化学的问题。当闭合该装置的电键时,观察到检流计的指针发生了偏转。
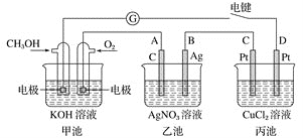
请回答下列问题:
(1)甲池为________(填“原电池”、“电解池”或“电镀池”),通入CH3OH一极的电极反应式为_____________________________________________________________;
(2)乙池中A(石墨)电极的名称为________(填“正极”、“负极”、“阴极”或“阳极”),总反应式为_________________________________________________________;
(3)当乙池中B极质量增加5.40 g时,甲池中理论上消耗O2的体积为________ mL(标准状况),丙池中________极析出________ g铜;
(4)若丙中电极不变,将其溶液换成NaCl溶液,电键闭合一段时间后,甲中溶液的pH将________(填“增大”、“减小”或“不变”);丙中溶液的pH将________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com