
分析 (1)温度升高C的物质的量增大,结合平衡移动原理分析判断,升温平衡向吸热反应方向进行;
(2)在一容积为2L的密闭容器中加入2molA和3molB,保持温度为30℃,在催化剂存在的条件下进行下列反应:A(g)+2B(g)3C(g),达到平衡后生成1.2mol C,此时,平衡混合气中C的体积分数为ω,依据化学平衡三段式列式计算得到;
A(g)+2B(g)=3C(g),
起始量(mol) 2 3 0
变化量(mol) 0.4 0.8 1.2
平衡量(mol) 1.6 2.2 1.2
解答 解:(1)若将温度升高到70℃后,其他条件均不变,当反应重新达到平衡时,C的物质的量为2.1mol大于30°C生成的C的物质的量,说明反应正向进行,平衡常数增大,升温反应向吸热反应方向进行,说明正向反应是吸热反应,△H>0,
故答案为:增大;>;
(2)在一容积为2L的密闭容器中加入2molA和3molB,保持温度为30℃,在催化剂存在的条件下进行下列反应:A(g)+2B(g)3C(g),达到平衡后生成1.2mol C,此时,平衡混合气中C的体积分数为ω;
A(g)+2B(g)=3C(g),
起始量(mol) 2 3 0
变化量(mol) 0.4 0.8 1.2
平衡量(mol) 1.6 2.2 1.2
平衡混合气中C的体积分数ω=$\frac{1.2mol}{5mol}$×100%=24%;
A物质的转化率与B物质的转化率之比=$\frac{0.4}{2}$:$\frac{0.8}{3}$=3:4;
故答案为:24%;3:4.
点评 本题考查化学平衡影响因素的分析判断,化学平衡的计算应用,等效平衡的分析方法,题目难度中等.


科目:高中化学 来源: 题型:选择题
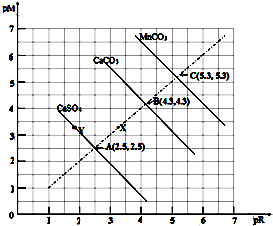
| A. | MnCO3在常温下的Ksp=2.5 x10-11(已知100.4=2.5) | |
| B. | 三种物质在常温下的溶解度大小顺序为MnCO3>CaCO3>CaSO4 | |
| C. | 处于Y点的CaSO4溶液中c(Ca2+)>c(SO42-) | |
| D. | Ca2+、CO32-浓度为X点的溶液可通过蒸发溶剂变为B点的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
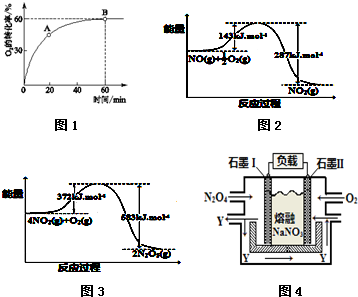
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4-(绿色)、Cr2O72-(橙红色)、CrO42-(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4-(绿色)、Cr2O72-(橙红色)、CrO42-(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 200 | 250 | 300 | 350 |
| 平衡常数K | 9.94 | 5.2 | 1 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,28 g 14CO和N2的混合物所含的质子数为14NA | |
| B. | 常温下,100mL 1mol•L-1 Na2CO3溶液中阴离子总数大于0.1NA | |
| C. | 将NA个NH3分子溶于1 L水中得到1 mol•L-1的氨水 | |
| D. | 将标况下22.4LC12通入足量NaOH溶液中充分反应转移电子数是2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com