
【题目】将碳酸钠和碳酸氢钠的混合物27.4g,加热到质量不再变化时剩余物质的质量为21.2g.再另取试样27.4g,加入某浓度盐酸100ml,恰好完全反应.(书写计算过程,否则记零分)
(1)求混合物中Na2CO3和NaHCO3的质量.
(2)计算盐酸的物质的量浓度.
【答案】
(1)解:设NaHCO3的物质的量为x,
2NaHCO3 |
| Na2CO3 | + | CO2↑ | + | H2O | △m |
2mol | 62g | ||||||
x | (27.4﹣21.2)g=6.2g |
则:x= ![]() =0.2mol,
=0.2mol,
混合物中碳酸氢钠的质量为m(NaHCO3)=0.2 mol×84g/mol=16.8g,
碳酸钠的质量为m(Na2CO3)=27.4g﹣16.8g=10.6 g,
答:原混合物中Na2CO3和NaHCO3分别为10.6g、16.8g
(2)解:根据(1)可知,27.4g混合物中含有0.2mol碳酸氢钠,含有10.6g碳酸钠,含有碳酸钠的物质的量为n(Na2CO3)= ![]() =0.1mol,
=0.1mol,
根据反应关系式:NaHCO3~HCl、Na2CO3~2HCl可知,该混合物完全反应消耗氯化氢的物质的量为0.2mol×1+0.1mol×2=0.4mol,
该盐酸的物质的量浓度为c(HCl)= ![]() =4mol/L,
=4mol/L,
答:该盐酸的物质的量的浓度为4mol/L
【解析】加热发生2NaHCO3 ![]() Na2CO3+CO2↑+H2O,与盐酸反应发生NaHCO3+HCl=NaCl+CO2↑+H2O、Na2CO3+2HCl=2NaCl+CO2↑+H2O,(1)加热混合物只有碳酸氢钠分解,根据质量的变化用差量法计算;(2)进入的盐酸恰好完全反应,根据反应计算出该盐酸的物质的量,再根据c=
Na2CO3+CO2↑+H2O,与盐酸反应发生NaHCO3+HCl=NaCl+CO2↑+H2O、Na2CO3+2HCl=2NaCl+CO2↑+H2O,(1)加热混合物只有碳酸氢钠分解,根据质量的变化用差量法计算;(2)进入的盐酸恰好完全反应,根据反应计算出该盐酸的物质的量,再根据c= ![]() 计算出盐酸浓度.
计算出盐酸浓度.


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是( )
A.12.4g Na2R含Na+0.4mol,则Na2R的摩尔质量为62 g/mol
B.同温、同压、同体积的H2和A2气体的质量分别是0.2g和3.2g,则A的相对原子质量为16
C.在标准状况下,CO和CO2混合气体共33.6 L,质量为50g,则两种气体的物质的量之比为1:1
D.浓盐酸的质量分数为36.5%,密度为1.19gcm﹣3 , 则物质的量浓度是11.9 molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的电离平衡曲线如图所示。下列说法中,正确的是

A. 图中A、D、E三点处KW间的关系:E处>A处>D处
B. 温度不变时,往水中通入适量HCl气体,可以使水的电离从A点变化到D点
C. 温度不变时,在水中加入适量CH3COONa固体,可以使水的电离从A点变化到C点
D. 在B点处,0.5 mol·L-1的H2SO4溶液与1 mol·L-1的KOH溶液等体积混合,充分反应后,所得溶液的pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是常见的有机物质,它易溶于水并有特殊香味;B的产量可衡量一个国家石油化工发展的水平.有关物质的转化关系如图1所示,请回答下列问题: 
(1)B的结构式为 . D的物质的名称是 .
(2)在①~④反应中,属于加成反应的是(填反应序号).
(3)写出下列反应的化学方程式:
反应①;反应②;反应③ .
(4)实验室用如图2所示装置进行反应④.
a.反应④的化学方程式是 .
b.试管乙中应加入,乙中的导管不能伸入到液面下的原因是 .
c.实验完成后,从试管乙中分离出有机物C的方法是
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】证明海带中含有碘元素的实验方案如下,请你按要求补充完整:
步骤 | 实验过程 | 实验用品 |
I | 将干海带灼烧灰化 |
|
II | 将海带灰溶解、过滤 |
|
III | 氧化滤液中的I﹣ , 反应的离子方程式为② |
|
IV | 取少量III中反应后溶液于试管中,加入少量CCl4并振荡后静置,观察到③ , 说明海带中含有碘元素 |
|
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨基甲酸铵(H2NCOONH4)是一种易分解、易水解的白色固体。某研究小组用下图所示的实验装置,利用浓氨水、干冰等作原料制备氨基甲酸铵。
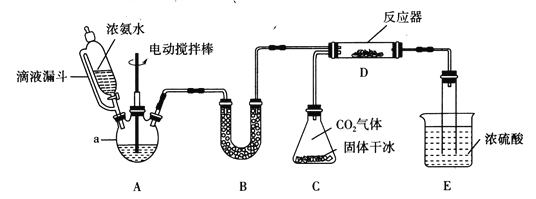
(1)仪器a的名称是____________;与分液漏斗相比,使用滴液漏斗的优点是:______________________________________。
(2)装置B中盛装药品的名称是________________。
(3)写出装置D中发生反应的化学方程式:__________________________________。
(4)装置E的作用之一是控制原料气按反应计量系数充分反应。若反应初期观察到装置内浓硫酸中产生气泡,应该______(填“加快”、“减慢”或“不改变”)产生氨气的流速;装置E的作用还有___________________________________________________。
(5)已知氨基甲酸铵可完全水解为碳酸氢铵。为测定氨基甲酸铵样品的纯度,取样品1.600g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为2.000g。
①写出碳酸氢铵与足量石灰水反应的离子方程式:______________________________。
②样品中氨基甲酸铵的质量分数为_____________%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铁铵[aFe2(SO4) 3·b(NH4) 2SO4·cH2O]广泛用于城镇生活饮用水、工业循环水的净化处理等。某化工厂以硫酸亚铁(含少量硝酸钙)和硫酸铵为原料,设计了如下工艺流程制取硫酸铁铵。

请回答下列问题:
(1)硫酸亚铁溶液加H2SO4酸化的主要目的是_________,滤渣A的主要成分是________。
(2)下列物质中最适合的氧化剂B是______(填字母);反应的离子方程式___________。
a.NaClO b.H2O2 c.KMnO4 d.K2Cr2O7
(3)操作甲名称分别是:甲______________,乙为常温晾干。
(4)上述流程中,氧化之后和加热蒸发之前,需取少量检验Fe2+是否已全部被氧化,所加试剂为__(写化学式),能否用酸性的KMnO4溶液?_________填“能”或“否”)理由是:_______。(可用语言或方程式说明)
(5)称取14.00 g样品,将其溶于水配制成100 mL溶液,分成两等份,向其中一份中加入足量NaOH溶液,过滤洗涤得到2.14 g沉淀;向另一份溶液中加入0.05 mol Ba(NO3)2溶液,恰好完全反应。则该硫酸铁铵的化学式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等质量的CH4和NH3相比较,下列结论错误的是
A. 它们的分子个数比为17:16 B. 它们的原子个数比为17:16
C. 它们的氢原子个数比为17:12 D. 它们所含氢元素的质量比为17:12
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com