
【题目】氨基甲酸铵(H2NCOONH4)是一种易分解、易水解的白色固体。某研究小组用下图所示的实验装置,利用浓氨水、干冰等作原料制备氨基甲酸铵。
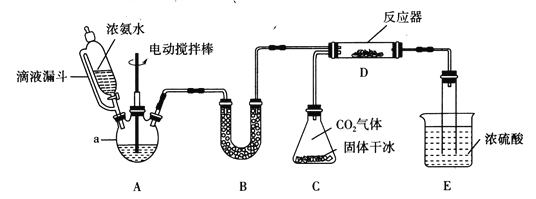
(1)仪器a的名称是____________;与分液漏斗相比,使用滴液漏斗的优点是:______________________________________。
(2)装置B中盛装药品的名称是________________。
(3)写出装置D中发生反应的化学方程式:__________________________________。
(4)装置E的作用之一是控制原料气按反应计量系数充分反应。若反应初期观察到装置内浓硫酸中产生气泡,应该______(填“加快”、“减慢”或“不改变”)产生氨气的流速;装置E的作用还有___________________________________________________。
(5)已知氨基甲酸铵可完全水解为碳酸氢铵。为测定氨基甲酸铵样品的纯度,取样品1.600g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为2.000g。
①写出碳酸氢铵与足量石灰水反应的离子方程式:______________________________。
②样品中氨基甲酸铵的质量分数为_____________%。
【答案】 三颈烧瓶 使滴液漏斗与三颈烧瓶内压强相等,便于液体顺利流下 碱石灰(或氧化钙或氢氧化钠固体) CO2+2NH3=H2NCOONH4 加快 防止氨气逸出,污染空气,同时防止倒吸,防止空气中的水蒸气进入反应器 NH4++HCO3-+Ca2++2OH-=CaCO3↓+NH3·H2O+H2O 97.5
【解析】(1)根据仪器a的构造特点可判断名称是三颈烧瓶;与分液漏斗相比,使用滴液漏斗的优点是使滴液漏斗与三颈烧瓶内压强相等,便于液体顺利流下。(2)生成的氨气中含有水蒸气,反应前需要干燥,因此装置B中盛装药品的名称是碱石灰(或氧化钙或氢氧化钠固体)。(3)根据装置图可知反应物是氨气和CO2,生成物是氨基甲酸铵(H2NCOONH4),则根据原子守恒可知装置D中发生反应的化学方程式为CO2+2NH3=H2NCOONH4。(4)若反应初期观察到装置内浓硫酸中产生气泡,这说明CO2的产生速率过快,有剩余,因此应该加快产生氨气的流速;氨气会污染大气,又因为氨基甲酸铵易水解,所以装置E的作用还有防止氨气逸出,污染空气,同时防止倒吸,防止空气中的水蒸气进入反应器。(5)①碳酸氢铵与足量石灰水反应的离子方程式为NH4++HCO3-+Ca2++2OH-=CaCO3↓+NH3·H2O+H2O。②碳酸钙的物质的量是2g÷100g/mol=0.02mol,根据碳原子守恒可知氨基甲酸铵的物质的量是0.02mol,质量是0.02mol×78g/mol=1.56g,则样品中氨基甲酸铵的质量分数为1.56g/1.60g×100%=97.5%。


科目:高中化学 来源: 题型:
【题目】化学科学需要借助化学专用语言描述,下列有关化学用语表示正确的是
A. 碳铵的化学式:(NH4)2CO3 B. COC12分子的结构式:![]()
C. HS-水解的离子方程式:HS-+H2O![]() H3O++S2- D. 硫酸氢钾加热熔融时的电离方程式:KHSO4=K++H++ SO42-
H3O++S2- D. 硫酸氢钾加热熔融时的电离方程式:KHSO4=K++H++ SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将碳酸钠和碳酸氢钠的混合物27.4g,加热到质量不再变化时剩余物质的质量为21.2g.再另取试样27.4g,加入某浓度盐酸100ml,恰好完全反应.(书写计算过程,否则记零分)
(1)求混合物中Na2CO3和NaHCO3的质量.
(2)计算盐酸的物质的量浓度.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应中伴随着能量变化.
(1)下列反应中,属于吸热反应的是(填序号).
a.燃烧CO b.Ba(OH)28H2O晶体和NH4Cl晶体反应
c.铝和稀盐酸反应 d.NaOH溶液和稀盐酸反应
(2)按如图1所示装置进行实验. 
【实验现象】反应剧烈,火星四射,漏斗下方有红热熔融物流出.
由此判断该反应是(填“吸热”或“放热”)反应,其反应的化学方程式是 , 其能量变化可用图2中的(填“a”或“b”)表示.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机反应中,有一种反应类型与其他3种反应类型不同的是( )
A.CH3COOH+CH3CH2OH ![]() CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
B.2CH3CH2OH+O2 ![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
C.CH4+Cl2 ![]() CH3Cl+HCl
CH3Cl+HCl
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用右图所示装置进行下列实验,能得出相应实验结论的是
选项 | ① | ② | ③ | 实验结论 |
|
A | 稀硫酸 | Na2SO3 | Na2SiO3溶 | 非金属性:S>Si | |
B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
C | 稀盐酸 | Na2SO3 | Ba(NO3)2溶液 | SO2与可溶性钡盐均可生成白色沉淀 | |
D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 酸性:硝酸>碳酸>硅酸 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法中不正确的是( )
A. 某温度时的混合溶液中c(H+)=![]() mol·L-1,说明该溶液呈中性
mol·L-1,说明该溶液呈中性
B. 常温下,由水电离出的c(H+)=10-12mol·L-1的溶液的pH可能为2或12
C. 已知Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=9.0×10-12,向含有Cl-、CrO42-且浓度均为0.010 mol·L-1溶液中逐滴加入0.010 mol·L-1的AgNO3溶液时,CrO42-先产生沉淀
D. 常温下pH=7的CH3COOH和CH3COONa混合溶液中,c(Na+)=c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上,以钛铁矿为原料制备二氧化钛的工艺流程如下图所示。钛铁矿主要成分为钛酸亚铁(FeTiO3,难溶于水),其中一部分铁元素在风化过程中会转化为+3价。

已知:TiOSO4遇水会水解。
(1)步骤①中,钛酸亚铁与硫酸反应的离子方程式为__________________。
(2)步骤③中,实现混合物的分离是利用物质的___________(填字母序号)。
a. 熔沸点差异 b. 溶解性差异 c. 氧化性、还原性差异
(3)步骤④的操作是_______________(填操作名称)。

(4)步骤④中将TiO2+转化为H2TiO3的原理TiO2++2H2O ![]() H2TiO3+ 2H+,该反应的△H_______0(填>或<);加水稀释,平衡_________(填“正向”、“逆向”或“不”)移动。
H2TiO3+ 2H+,该反应的△H_______0(填>或<);加水稀释,平衡_________(填“正向”、“逆向”或“不”)移动。
(5)可以利用生产过程中的废液与软锰矿(主要成分为MnO2)反应生产硫酸锰(MnSO4,易溶于水),该反应的离子方程式为__________________________。
(6)研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,利用如图所示装置获得金属钙,并以钙为还原剂,还原二氧化钛制备金属钛。在制备金属钛前后,CaO的总量不变,其原因是(请用化学方程式解释)______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com