
| A.用蒸馏水润湿的pH试纸所测定的某酸溶液的pH |
| B.用容量瓶配制溶液,定容后摇匀液面下降,再加蒸馏水至刻度线所配制的溶液浓度 |
| C.用仰视量筒刻度量取的一定量浓硫酸所配制的0.1mol?L-1H2SO4溶液的浓度 |
| D.用待测液润洗的锥形瓶进行中和滴定所测定的待测液浓度 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:单选题
| A.称取4.77gNa2CO3固体溶于水配成450mL溶液 |
| B.称取5.3gNa2CO3固体溶于水配成500mL溶液 |
| C.称取12.9gNa2CO3?10H2O固体溶于水配成450mL溶液 |
| D.量取90mL0.5mol/LNa2CO3溶液加360mL水稀释 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
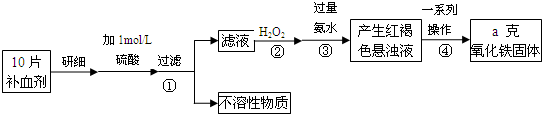
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题

查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com