
【题目】设NA表示阿伏伽德罗常数,下列叙述中正确的是( )
A.常温常压下,11.2 LCO2所含的原子数为1.5NA
B.标准状况下,1 L水所含分子数为 ![]()
C.标准状况下,22.4 L H2中所含原子数为NA
D.常温常压下,48 g O3含有的氧原子数为3NA
【答案】D
【解析】A.不是标况下,不能使用标况下的气体摩尔体积22.4L/mol计算11.2LCO2的物质的量,故A不符合题意;
B.标况下水不是气体,不能使用标况下的气体摩尔体积计算1L水的物质的量,故B不符合题意;
C.标况下水不是气体,不能使用标况下的气体摩尔体积计算1L水的物质的量,故C不符合题意;
D.48g臭氧的物质的量为: ![]() =1mol,1mol臭氧中含有3mol氧原子,含有的氧原子数为3NA,故D符合题意;
=1mol,1mol臭氧中含有3mol氧原子,含有的氧原子数为3NA,故D符合题意;
故答案为:D.
A.常温常压下气体摩尔体积不是22.4L/mol;
B.标准状况下水是液体,不适用气体摩尔体积;
C.氢气是双原子分子;
D.根据臭氧的摩尔质量计算含有氧原子的数目即可。


科目:高中化学 来源: 题型:
【题目】金刚石是典型的原子晶体,下列关于金刚石的说法中错误的是( )
A.晶体中不存在独立的“分子”
B.碳原子间以共价键相结合
C.金刚石是硬度最大的物质之一
D.化学性质稳定,即使在高温下也不会与氧气发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置,密闭容器内分别充入空气(已知空气体积占整个容器容积的 ![]() )和H2、O2的混合气体在可移动的活塞两边,在标准状况下若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央,则原来H2、O2的体积比最接近于( )
)和H2、O2的混合气体在可移动的活塞两边,在标准状况下若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央,则原来H2、O2的体积比最接近于( )
A.2:7或5:4
B.2:1或5:4
C.4:5或7:2
D.2:1或7:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某100mL溶液中含有的部分离子浓度大小如图所示,该溶液可能还含有Fe3+、Ba2+、K+、OH﹣、NO3﹣、CO32﹣、SO42﹣ . 为了进一步确认,对该溶液进行实验检测:
①仔细观察,该溶液呈无色、透明、均一状态.
②向100mL溶液中滴入稀硫酸,有23.3g白色沉淀产生,再加稀硝酸,白色沉淀不消失.回答下列问题:由此可知,除了含有Na+、Mg2+、Cl﹣外,该溶液中肯定还含有的离子及其物质的量浓度为 , 肯定没有的离子是 , 可能含有的离子是 . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用98%的浓硫酸(其密度为1.84 g/cm3)配制100mL 1.0molL﹣1的稀硫酸,若实验仪器有:
A.100mL量筒 B.托盘天平 C.玻璃棒 D.50mL容量瓶
E.10mL量筒 F.50mL烧杯 G.100mL容量瓶
(1)该浓硫酸的物质的量浓度为mol/L;需量取浓硫酸的体积为mL.
(2)实验时选用的仪器有(填序号A﹣G) , 要完成上述实验,除了上述仪器外,还必需 .
(3)配制过程中,下列情况会使配制结果偏高的是(填序号①﹣④)
①定容时俯视刻度线观察液面
②容量瓶使用时未干燥
③定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
④浓硫酸稀释后,未冷却就转移至容量瓶中,并立即完成定容.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D代表4种元素.请填空:
(1)A元素的原子核外s电子与p电子数之比为1:1,A的原子结构示意图为;
(2)B元素的原子基态时被电子占据的轨道有9个,其中6个被电子占满,B元素符号为;
(3)C元素基态原子核外的未成对电子数是前四周期元素中最多的.C基态原子的外围电子的原子轨道表示式为;
(4)D元素的正三价离子的3d亚层为半充满,D元素的原子的核外电子排布式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中有A、B两种物质,在一定的条件下反应:2A(气)+B(固)2C(气)△H>0达到平衡后,改变一个条件(X),下列量(Y)一定符合图中曲线的是( )
X | Y | |
A | 减小压强 | A的转化率 |
B | 升高温度 | 混合气体平均分子量 |
C | 升高温度 | A的浓度 |
D | 增加压强 | B的转化率 |

A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在材料应用与发现方面,中华民族有着卓越的贡献。下列说法错误的是
A.黏土烧制成陶器过程中发生了化学变化B.区分真丝产品与纯棉织物可以用灼烧法
C.离子交换法净化水为物理方法D.“玉兔号”月球车帆板太阳能电池的材料是单质硅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.实验室需要0.1molL﹣1NaOH溶液500mL.根据溶液的配制情况回答下列问题.
(1)在如图所示仪器中,配制上述溶液肯定不需要的是(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器是 . 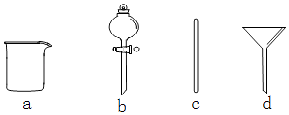
(2)配制时,其正确的操作顺序是(用字母表示,每个操作只用一次) .
A.用少量水洗涤烧杯2次~3次,洗涤液均注入容量瓶,振荡
B.在盛有NaOH固体的烧杯中加入适量水溶解
C.将烧杯中已冷却的溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,反复上下颠倒,摇匀
E.改用胶头滴管加水,使溶液凹液面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1cm~2cm处
(3)实验两次用到玻璃棒,其作用分别是:先用于、后用于 .
(4)关于容量瓶的四种叙述:①是配制准确浓度溶液的仪器;②不宜贮存溶液;③不能用来加热;④使用之前要检查是否漏水.这些叙述中正确的是
A.①②③④
B.②③
C.①②④
D.②③④
(5)根据计算用托盘天平称取的质量为g.
(6)Ⅱ.若配制1mol/L的稀硫酸溶液500mL
则需要质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为mL(计算结果保留一位小数).如果实验室有10mL、25mL、50mL量筒,应选用mL规格的量筒最好.
(7)下面操作造成所配稀硫酸溶液浓度偏高的是
A.溶解后溶液没有冷却到室温就转移
B.转移时没有洗涤烧杯、玻璃棒
C.向容量瓶加水定容时眼睛俯视液面
D.用量筒量取浓硫酸后洗涤量筒并把洗涤液转移到容量瓶
E.摇匀后发现液面低于刻度线,又加蒸馏水至刻度线.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com