
����Ŀ��������ԭ�ζ�ʵ��ͬ�к͵ζ����ƣ����� 0.01 mol/L ���� KMnO4 ��Һ�ζ� V1mL δ֪Ũ�ȵ���ɫ Na2SO3��Һ���ش��������⣺
��1���õζ�ʵ����ʹ�õ�����������̨���ζ��ܼС��ձ��⣬�����������е�___________________________(�����)��
A����ʽ�ζ��� B����ʽ�ζ��� C����Ͳ D����ƿ E����ͷ�ι� F��©��
��2����Ӧ�����ӷ���ʽΪ ____________________________��
��3���ζ��������Ƿ���Ҫָʾ�� _____________________________������������������������˵������ ____________________��
��4���ζ�ǰƽ�� KMnO4 ��Һ��Һ�棬�̶�Ϊ x mL���ζ�����Һ�棬�̶�Ϊ y mL����(y��x) mL ��ʵ������ KMnO4��Һ��� ____________________________(����ƫ��������ƫ����)��
��5���ζ��յ������Ϊ _____________________________��
��6���ζ��յ����� 0.01 mol/L ���� KMnO4 ��Һ���Ϊ V2mL ���� Na2SO3 ��Һ��Ũ��Ϊ__________________��
���𰸡�ABD 2MnO4-+5SO32-��6H�� ===2Mn2����5SO42-��3H2O �� ��Ϊ��ɫ��KMnO4����ԭΪMn2������ɫ��ȥ��KMnO4��������ָʾ�� ƫ�� ��Һ����ɫǡ�ñ�Ϊdz��ɫ���Ұ�����ڲ���ɫ 0.025V2/V1 mol/ L
��������
��1���ζ�ʵ��ʱ��Ҫ����̨���ζ��ܼС��ձ�����ƿ����ʽ�ζ��ܺͼ�ʽ�ζ��ܣ�
��2��������ԭ�ζ���������������ԭ��Ӧ������ KMnO4 ��Һ��SO32-����ΪSO42-����������ԭΪMn2+��
��3������ KMnO4 ��ҺΪ��ɫ���ﵽ�ζ��յ�ʱ����Һ��ɫ��
��4���ζ�ǰƽ�� KMnO4 ��Һ��Һ�棬�̶�Ϊ x mL���ζ�����Һ�棬���õ����ƫС��
��5���ﵽ�ζ��յ�ʱ����Һ����ɫ��Ϊdz��ɫ����
��6�����ݹ�ϵ2MnO4-~5SO32-���м��㡣
��1���ζ�ʵ����ʹ�õ�����������̨���ζ��ܼС��ձ��⣬������ƿ����ʽ�ζ��ܺͼ�ʽ�ζ��ܣ�
��2��������ԭ�ζ���������������ԭ��Ӧ������ KMnO4 ��Һ��SO32-����ΪSO42-����������ԭΪMn2+�����ӷ���ʽΪ��2MnO4-+5SO32-��6H�� ===2Mn2����5SO42-��3H2O��
��3������ KMnO4 ��ҺΪ��ɫ���ﵽ�ζ��յ�ʱ����Һ��ɫ���������������ָʾ��������Ҫ����µ�ָʾ����
��4���ζ�ǰƽ�� KMnO4 ��Һ��Һ�棬�̶�Ϊ x mL���ζ�����Һ�棬���õ����ƫС���̶�Ϊ y mLʱ����ʵ������ KMnO4��Һ���ƫС��
��5����Һ����ɫ��Ϊdz��ɫ���Ұ���Ӳ���ɫ��֤���ﵽ�ζ��յ㣻
��6����Ӧ�����ĸ�����ص����ʵ���=0.01mol/L�� V2��10-3L����ôNa2SO3 ��Һ��Ũ��=![]() =
=![]() mol/L��
mol/L��
�ζ����� | ��ԭ���ζ�KMnO4 | KMnO4�ζ���ԭ�� | I2�ζ���ԭ�� | ��ԭ���ζ�I2 | ���εζ���ԭ�� | ��ԭ���ζ����� |
ָʾ�� | KMnO4 | KMnO4 | ���� | ���� | KSCN | KSCN |
�յ�ʱ��ɫ�仯 | dz��ɫ����ɫ | ��ɫ��dz��ɫ | ��ɫ��span>��ɫ�� | ��ɫ����ɫ | ��Һ���ɫ | ��ɫ��ʧ |


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NH3���й㷺����;��ʵ���ҳ�����ͼ��ʾװ����ȡ���ռ�NH3��

��1��ʵ������NH4Cl��Ca(OH)2��ȡNH3�Ļ�ѧ����ʽΪ______��
��2������NH3Ӧѡ�õĸ������______��
��3��ͼ1�з������ռ�NH3��װ�ÿ�ѡ��ͼ2�е�______������ţ���
��4��β������װ����ʹ�õ���©����������______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵ���Ũ��Ϊ0.1 mol��L��1��Na2CO3��Һ100 mLʱ�����в�����ȷ����(����)
A. ��������ƽ��ȡ1.06 g��ˮ̼���ƣ����ձ��м�����ˮ�ܽ⣬����ȴ�����º���Һת�Ƶ�����ƿ��
B. ��ʹ������ƿǰ����������ƿ�Ƿ�����Լ�ƿ�����Ƿ�©ˮ
C. ����ʱ������ˮ�����̶��ߣ����ý�ͷ�ι�С���������ಿ��
D. ����ʱ�������ӣ���������Һ��Ũ�Ƚ�ƫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)��CuSO4��Һ�м���һ������Na2SO3��NaCl��Һ���ȣ�����CuCl������д������CuCl�����ӷ���ʽ________________________________
(2)������H2CrO4��N2H4��ԭΪCr3����ͬʱ�ų�����Ⱦ�����壬д��������Ӧ�����ӷ���ʽ_________�����������뻹ԭ��������ʵ���֮��Ϊ________��
(3)��ȥ��Һ�е�AsCl3�����ô�������(NaH2PO2)��ԭAsCl3����������ɫ�����������H3PO3���÷�Ӧ�Ļ�ѧ��Ӧ����ʽΪ______________________�������ͻ�ԭ�������ʵ���֮��Ϊ________������������________��
(4)FeS��ˮ��Һ��Cl2���������������Һ�еμ�BaCl2�в��ܽ�������İ�ɫ�������ɣ���ˮ��Һ��FeS��Cl2��Ӧ�����ӷ���ʽΪ_______________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ҹ�����Դ�����У�������Ҫ��ս�Խ�����Դ����������ij����(��Ҫ�ɷ�ΪCr2O3��������Ҫ��FeO��SiO2��)Ϊԭ������Cr2O3�Ĺ������̣�

��֪��Ksp[Mg(OH)2]��1.8��10��11��Ksp[Cr(OH)3]��6.4��10��31��
(1)������������ʽ��ʾ�������ɣ���Fe2SiO4�ɱ�ʾΪ____________��
(2)����ʱͨ��������������__________________________________________
(3)��������ʱ����MgSO4��(NH4)2SO4���������Һ��������PO43-��AsO43-��SiO32-��Ӧ��ʹ��ֱ�ת��ΪNH4MgPO4��NH4MgAsO4��MgSiO3������ȥ����÷�ӦpH������ʵĹ�ϵ��ͼ��ʾ��

�ٷ�Ӧ�����п�����ҺpHΪ9��pH>9ʱ�����ʽ��͵�ԭ����_________��
�ڷ�Ӧ���¶ȿ�����80 �����ң��¶Ȳ���̫�ߵ���Ҫԭ����___________��
(4)����ԭ��ʱ�ȵ�����ҺpH���ټ��뽹��������(Na2S2O5)��
���������ԭ����Ӧ�����ӷ���ʽ��________Cr2O72-��________S2O32-��________===________Cr3����________SO42-��________
����֪��Һ��c(Cr2O72-)��0.32 mol��L��1��Ϊ�˲��ڻ�ԭ�����в���Cr(OH)3������Ӧ������Һ��pH������________��
(5)������������Ҫ������Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����жԸ��������Һ�ķ�����ȷ���ǣ� ��
A.��������Һ���ܴ�����������ӣ�K����Na+��NO3-��CO32-
B.Ca(HCO3)2��Һ�����NaOH��Һ��Ӧ��HCO3-+Ca2��+OH-=CaCO3��+H2O
C.0.1molL��1Na2S��Һ�д��ڣ�c(OH-)=c(H+)+c(HS��)+2c(H2S)
D.NH4HSO4��Һ�����Ե���Ҫԭ���ǣ�NH4��+H2O![]() NH3H2O+H��
NH3H2O+H��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����淴ӦaA��g��+bB��s��![]() cC��g��+dD��g���������������䣬C�����ʵ����������¶ȣ�T����ѹǿ��P����ϵ��ͼ��������ȷ���ǣ�������
cC��g��+dD��g���������������䣬C�����ʵ����������¶ȣ�T����ѹǿ��P����ϵ��ͼ��������ȷ���ǣ�������

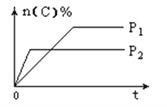
A. �����¶ȣ�ƽ��������Ӧ�����ƶ� B. ʹ�ô�����C�����ʵ�����������
C. ��ѧ����ʽϵ��a��c+d D. ����ͼ����ȷ���ı��¶Ⱥ�ƽ���ƶ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ A2+3B22C �ķ�Ӧ�����»�ѧ��Ӧ���ʵı�ʾ�У���Ӧ����������
A.��(A2) = 0.4 mol��L-1��s-1B.��(B2) = 0.8 mol��L-1��s-1
C.��(C) = 0.6 mol��L-1��s-1D.��(B2) = 4.2 mol��L-1��min-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ʵ���Ũ�Ⱦ�Ϊ![]() �Ģ�
�Ģ�![]() ��Һ ��
��Һ ��![]() ��Һ��
��Һ�� ![]() ��Һ��25mL������˵����ȷ����
��Һ��25mL������˵����ȷ����
A.3����ҺpH�Ĵ�С˳���Ǣ�>��>��
B.����3����Һϡ����ͬ������pH�仯�����Ǣ�
C.���ֱ����25mL ![]() �����pH��С���Ǣ�
�����pH��С���Ǣ�
D.�������¶ȣ���۵�pH����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com