
���ݱ��渲�ǵ������������������Ӳ�IJ��֣����ű������ݵ����ã�����Ҫ�ɷ�Ϊ�ǻ������[Ca5(PO4)3OH]�������ݱ������������ƽ�⣺�� ��
Ca5(PO4)3OH(s) 5Ca2+(aq)��3PO43-(aq)��OH-(aq) Ksp = 6.8��10-37 mol9��L-9
5Ca2+(aq)��3PO43-(aq)��OH-(aq) Ksp = 6.8��10-37 mol9��L-9
����˵��������ǣ� ��
| A�������������ϵ��Ƿ��ͻ����H+���������������ȣ�� |
| B��������ƽ���֪��С������ʱҪ�ٳ��Ƕಹ�� |
| C������СOH-��Ũ�ȣ�����ƽ�⽫�����ƶ���Ksp��ֵ��Ӧ���� |
| D��ʹ�ú��������ܷ�ֹȣ�ݣ�����ΪCa5(PO4)3OH(s)ת��Ϊ�����ܵ�Ca5(PO4)3F(s)[Ca5(PO4)3F(s)��Ksp = 2.8��10-61 mol9��L-9] |
C
�������������A�������������ϵ��Ƿ��ͻ����H�����ͳ����ܽ�ƽ���е����������ӷ�Ӧ�ٽ�ƽ��������У��������ݵ��ǻ�������ܽ⣬�����ȣ�ݣ�A��ȷ��B��Ca5��PO4��3OH��s�� 5Ca2����aq��+3PO43����aq��+OH����aq�� ����ƽ���֪�����������Ũ�� ��ʹƽ�����ƣ���ֹ�������ݵ��ǻ�������ܽ⣬B��ȷ��C�������ܼ�ƽ����ܶȻ�ֻ���¶ȱ仯������Ũ�ȱ仯��C����D���ǻ�����Ƶ�KspС�ڷ�����ƣ����������������ӱ���ͬ��֤��������Ƹ����ܽ⣬���������ݵ����ã�D��ȷ����ѡC��
5Ca2����aq��+3PO43����aq��+OH����aq�� ����ƽ���֪�����������Ũ�� ��ʹƽ�����ƣ���ֹ�������ݵ��ǻ�������ܽ⣬B��ȷ��C�������ܼ�ƽ����ܶȻ�ֻ���¶ȱ仯������Ũ�ȱ仯��C����D���ǻ�����Ƶ�KspС�ڷ�����ƣ����������������ӱ���ͬ��֤��������Ƹ����ܽ⣬���������ݵ����ã�D��ȷ����ѡC��
���㣺���ܵ���ʵ��ܽ�ƽ�⼰����ת���ı���


 ̽���빮�̺��Ͽ�ѧ����������ϵ�д�
̽���빮�̺��Ͽ�ѧ����������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
0.1mol��L��1Na2S��Һ�����й�ϵ��ȷ����
| A��c(Na+)=2c(S2��) |
| B��c(OH��)="c" (H+)+c (HS��)+2c (H2S) |
| C��c(Na+) ��c(S2��) ��c (HS��) ��c (OH��) |
| D��c(Na+)+c (H+)="2c" (S2��)+c (HS��)+c (OH��) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��֪NH4+��HCHO��ˮ��Һ�з������·�Ӧ��4NH4++6HCHO��(CH2)6N4+4H++6H2O������ijһ��Σ�Ϊ�ⶨ�䵪��������������ȡ�����Ʒm g������ˮ���ټ�������HCHO��Һ���100 mL��Һ����ַ�Ӧ����ȡ��V1 mL��Һ����c mol��L-1��NaOH��Һ�����к͵ζ���ǡ����ȥV2 mL�����������е�Ԫ�ص���������Ϊ��
A�� | B�� | C��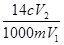 | D�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
����˵���У���ȷ����
| A��ij���ӱ�������ȫ��ָ����������Һ�е�Ũ�ȱ�Ϊ0 |
| B��ij���ʵ��ܽ���Ϊ���ܣ�������ʵ��ܽ��Ϊ0 |
| C��һ����˵���ܽ��С������������ת��Ϊ�ܽ�ȴ�������� |
| D�����������ɡ��ܽ��ת����ʵ�ʶ��dz����������ܽ�ƽ����ƶ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
25��ʱ����Ũ�Ⱦ�Ϊ0.1mol.L��1��Fe(NO3)3��Al��NO3��3�����Һ�У���μ���NaOH��Һ����ʾ����Al��OH��3�����ʵ���������NaOH��Һ������Ĺ�ϵ����ͼ��ʾ����֪������Ũ��С��1��10��5mol.L-1ʱΪ������ȫ����������˵�����жϺ�������
| A��25��ʱ��Fe��OH��3���ܽ�ȴ���Al��OH��3���ܽ�� |
| B��25��ʱ��Fe��OH��3���ܶȻ�����Al��OH��3���ܶȻ� |
| C�������ɵ�Al��OH��3ǡ����ȫ�ܽ�ʱ����Һ�е�����ֻ��NaAlO2 |
| D��ͼ��2a��b��6��c��b�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��������ʵ�鲻��֤��һԪ��HRΪ�������
| A������ʱ��NaR��Һ��pH����7 |
| B���μ���ɫʯ����Һ����Һ���ɫ |
| C��HR��Һ��������NaR���壬�ܽ����Һ��pH��� |
| D������ʱ��0.01mol?L��1��HR��ҺpH=4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
25��ʱ����pH��1�����ᣬ������������ȷ����
| A��c(H+)�� c(Cl��)�� c(OH��) |
| B��c(H+)��c(OH��)��1��0��10��14 |
| C����ˮ�������c(H+)��1��0��10��13mol?L��1 |
| D����pH��13��NaOH��Һ��Ϻ����Һһ�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
�����£�������Һ�и���Ũ�ȹ�ϵ����ȷ���ǣ� ��
| A��PH��ȵĢ�CH3COONa��C6H5ONa��NaHCO3��Һ�У�C(Na+)��С��ϵ���٣��ۣ��� |
| B����ˮ�еμ�ϡ��������Һ�����ԣ�C(NH4+)��C(SO42-)��C(OH-)=C��H+) |
| C����1L 0.1mol/L��NaOH��Һ��ͨ��6.6gCO2��2C��Na+)=3[C(CO32-)+C(HCO3-)+C(H2CO3)] |
| D��CH3COONa��Һ�м�������KNO3��ļ�����Һһ���У�C(Na+)+C(H+)=C(CH3COO-)+C(OH-) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
����˵������ȷ���ǣ��� ��
| A�����Բ��ܽ�������Dz����ڵ� |
| B��������ˮ�������ܽ��Ϊ0 |
| C�����ʵ��ܽ���Ϊ���ܣ�������ʲ�����ˮ |
| D��ij���ӱ�������ȫ��ָ����������Һ�е�Ũ��Ϊ0 |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com