
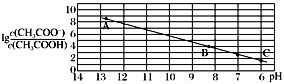
【题目】25 ℃时,将0.10 mol·L-1 CH3COOH溶液滴加到10mL 0.10mol·L-1NaOH溶液中,lg![]() 与pH的关系如图所示,C点坐标是(6,1.7)。(已知:lg5=0.7)下列说法正确的是
与pH的关系如图所示,C点坐标是(6,1.7)。(已知:lg5=0.7)下列说法正确的是
A.Ka(CH3COOH)=5.0×10-5
B.Ka(CH3COOH)=5.0×10-6
C.pH=7时加入的醋酸溶液的体积小于10 mL
D.B点存在c(Na+)-c(CH3COO-)=(10-6-10-8)mol·L-1
【答案】A
【解析】
醋酸的电离常数![]() ,取对数可得到
,取对数可得到![]() ;
;
A. 据以上分析,将C点坐标(6,1.7)代入![]() ,可得lg Ka(CH3COOH)=1.7-6=-4.3,Ka(CH3COOH)=5.0×10-5,A正确;
,可得lg Ka(CH3COOH)=1.7-6=-4.3,Ka(CH3COOH)=5.0×10-5,A正确;
B. 根据A项分析可知,B错误;
C. 当往10 mL 0.10 mol·L-1 NaOH溶液中加入10 mL 0.10 mol·L-1醋酸溶液时,得到CH3COONa溶液,溶液呈碱性,故当pH=7时加入的醋酸溶液体积应大于10mL,C错误;
D. B点![]() ,又lg Ka(CH3COOH)=1.7-6=-4.3,则由
,又lg Ka(CH3COOH)=1.7-6=-4.3,则由![]() 得,pH=8.3,c(H+)=10-8.3 mol·L-1,结合电荷守恒式:c(CH3COO-)+ c(OH-)=c(H+)+c(Na+)知,c(Na+)-c(CH3COO-)=c(OH-)-c(H+)=(10-5.7-10-8.3) mol·L-1,D错误;
得,pH=8.3,c(H+)=10-8.3 mol·L-1,结合电荷守恒式:c(CH3COO-)+ c(OH-)=c(H+)+c(Na+)知,c(Na+)-c(CH3COO-)=c(OH-)-c(H+)=(10-5.7-10-8.3) mol·L-1,D错误;
答案选A。


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
【题目】某元素的原子最外层电子排布式是![]() ,该元素或其单质不可能具有的性质是( )
,该元素或其单质不可能具有的性质是( )
A.该元素的金属性比铝元素的强
B.该元素的单质在一定条件下能与盐酸反应
C.该元素位于第五周期ⅢA族
D.该元素的最高化合价为+5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属原子在二维平面里放置有如图所示的两种方式,下列说法正确的是( )
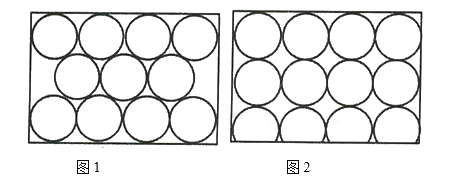
A.图1为非密置层,配位数为6
B.图2为密置层,配位数为4
C.图1在三维空间里堆积可得A3型和A1型两种堆积模型
D.图2在三维空间里堆积可得A3型堆积模型
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肉桂酸(![]() )是制备感光树脂的重要原料,某肉桂酸粗产品中含有苯甲酸及聚苯乙烯,各物质性质如表:
)是制备感光树脂的重要原料,某肉桂酸粗产品中含有苯甲酸及聚苯乙烯,各物质性质如表:
名称 | 相对分子质量 | 熔点(℃) | 沸点(℃) | 水中溶解度(25℃) |
苯甲醛 | 106 | -26 | 179.62 | 微溶 |
聚苯乙烯 | 104n | 83.1~105 | 240.6 | 难溶 |
肉桂酸 | 148 | 135 | 300 | 微溶(热水中易溶) |
实验室提纯肉桂酸的步骤及装置如下(部分装置未画出),试回答相关问题:
2g粗产品和30mL热水的混合物![]()
![]() 滤液
滤液![]()
![]() 称重
称重
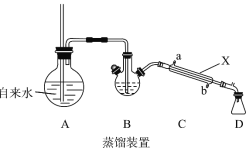
(1)装置A中长玻璃导管的作用是_________,步骤①使苯甲醛 随水蒸汽离开母液,上述装置中两处需要加热的仪器是____________(用字母 A、B、C、D回答)。
(2)仪器X的名称是_______,该装置中冷水应从___________口(填a或b)通入。
(3)步骤②中,10%NaOH溶液的作用是___________,以便过滤除去聚苯乙烯杂质。
(4)步骤④中,证明洗涤干净的最佳方法是________,若产品中还混有少量NaCl,进一步提纯获得肉桂酸晶体方法为_________________。
(5)若本实验肉桂酸粗产品中有各种杂质50%,加碱溶解时损失肉桂酸10%,结束时称重得到产品0.6g,若不计操作损失,则加盐酸反应的产率约为_____%(结果精确至0.1%)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋动物海鞘中含有种类丰富、结构新颖的次生代谢产物,是海洋抗肿瘤活性物质的重要来源之一。一种从海鞘中提取具有抗肿瘤活性的天然产物的流程如下:
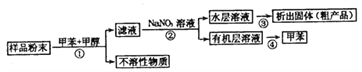
下列关于该流程中各步骤的说法中,错误的是( )
选项 | 步骤 | 采用装置 | 主要仪器 |
A | ① | 过滤装置 | 漏斗 |
B | ② | 分液装置 | 分液漏斗 |
C | ③ | 蒸发装置 | 坩埚 |
D | ④ | 蒸馏装置 | 蒸馏烧瓶 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数逐渐增大的A、B、C、D、E五种短周期主族元素的部分信息如下表:
元素代号 | 信息 |
A | 原子的最外层电子数为内层电子总数的3倍 |
B | 金属性最强的短周期元素 |
C | 原子的最外层电子数是次外层的 |
D | 原子是最外层电子数A原子的最外层电子数的一半 |
E | 最高价氧化物对应的水化物是最强的无机酸 |
请根据以上信息回答问题。
(1)C的氧化物的化学式为_______________A原子结构示意图为_______________。
(2)B、C、D形成的单质的熔点从低到高的顺序为_______________(填元素符号)。
(3)A、C所形成的化合物的晶体结构与氯化钠晶体结构相似,则晶胞中每个阳离子周围等距且紧邻的阴离子数目为_______________,晶体中阴、阳离子个数比为_______________。
(4)A、D所形成晶体的熔点比C、E所形成晶体的熔点_______________(填“高”或“低”),原因是_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸锰是制取其他含锰化合物的原料,也可用作脱硫的催化剂等。一种焙烧氯化铵和菱锰矿粉制备高纯度碳酸锰的工艺流程如图所示
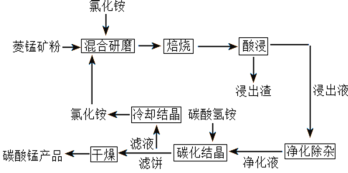
已知①菱锰矿粉的主要成分是MnCO3,还有少量的Fe、Al、Ca、Mg等元素
②常温下,相关金属离子在浓度为0.1mol/L时形成M(OH)n沉淀的pH范围如表
金属离子 | Al3+ | Fe3+ | Fe2+ | Ca2+ | Mn2+ | Mg2+ |
开始沉淀的pH | 3.8 | 1.5 | 6.3 | 10.6 | 8.8 | 9.6 |
沉淀完全的pH | 5.2 | 2.8 | 8.3 | 12.6 | 10.8 | 11.6 |
③常温下,Ksp(CaF2)=1.46×1010,Ksp(MgF2)=7.42×1011;Ka(HF)=1.00×104
回答下列问题:
(1)“混合研磨”的作用为_______________________
(2)“焙烧”时发生的主要反应的化学方程式为_________________________________
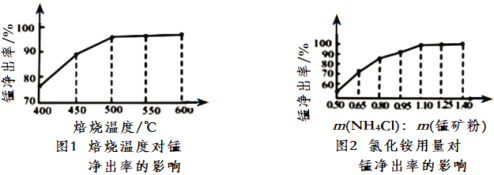
(3)分析图1、图2,焙烧氯化铵、菱锰矿粉的最佳条件是_____________________________
(4)净化除杂流程如下
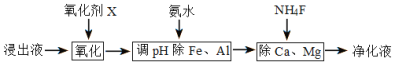
①已知几种物质氧化能力的强弱顺序为(NH4)2S2O8>KMnO4>MnO2>Fe3+,则氧化剂X宜选择__________
A. (NH4)2S2O8 B. MnO2 C. KMnO4
②调节pH时,pH可取的范围为_________________
③常温下加入NH4F将Ca2+、Mg2+沉淀除去,此时溶液中,![]() =______若此时pH为6,c(Mg2+)= a mol/L,则c(HF)为______________ mol/L (用a表示)
=______若此时pH为6,c(Mg2+)= a mol/L,则c(HF)为______________ mol/L (用a表示)
(5)“碳化结晶”过程中不能用碳酸铵代替碳酸氢铵,可能的原因是__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,几种弱电解质的pK(pK=-lgK)如下表所示:
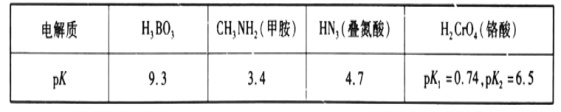
请回答下列问题:
(1)硼酸(H3BO3)在水中存在电离平衡:H3BO3+H2O![]() B(OH)4-+H+。由此推断,硼酸是___(填字母)。
B(OH)4-+H+。由此推断,硼酸是___(填字母)。
A.一元酸 B.三元酸 C.强酸 D.弱酸
(2)常温下,在H3BO3、HN3、H2CrO4中酸性最强的是___(填化学式)。
(3)H2CrO4的二级电离常数表达式Ka2=___。
(4)甲胺在水中的电离和NH3类似,写出CH3NH2在水中的电离方程式:___。
(5)常温下,20mLpH=2的HN3溶液与xmLpH=12的NaOH溶液恰好完全反应,则x___(填“>”“<”或“=”)20mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,100 mL 1.0 mol/L Na2C2O4 溶液中加入足量pH=1的稀硫酸,再加入20 mL KMnO4溶液恰好完全反应。下列说法正确的是( )
A.Na2C2O4溶液中C2O42-数目为0.1N A
B.稀硫酸中水电离的c(H+)=0.1 mol/L
C.KMnO4溶液浓度为0.1 mol/L
D.反应过程中转移电子数为0.2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com