
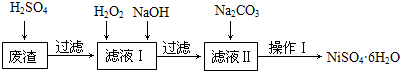
| Fe(OH)2 | Fe(OH)3 | Cr(OH)3 | Ni(OH)2 | |
| Ksp | 8.0×10-16 | 4.0×10-38 | 6.0×10-31 | 6.5×10-18 |
| 完全沉淀pH | ≥9.6 | ≥3.2 | ≥5.6 | ≥8.4 |
分析 废渣(除含镍外,还含有Cu、Fe、Cr等杂质),在硫酸溶解过滤后除去不溶于硫酸的铜,所以滤液含有二价铁离子、三价铁离子、三价铬离子杂质,加H2O2是将二价铁氧化成三价铁,再通过调节PH值5.6~8.4使三价铁和三价铬都以氢氧化物的沉淀而除去,滤液Ⅱ含有可溶性硫酸盐,为Na2SO4、NiSO4,再加碳酸钠沉淀二价镍,过滤、洗涤,然后与硫酸反应生成NiSO4.
(1)能提高废渣浸出率从反应效率考虑分析;
(2)根据H2O2强氧化性及其除杂离子的原理分析;
(3)经过加入H2O2、NaOH后可除去Cu、Zn、Fe、Cr等杂质,滤液中含有可溶性硫酸盐;
(4)检验废液中是否还含有Ni2+离子;
(5)得到NiCO3沉淀之后应,应先过滤、洗涤,然后与硫酸反应生成NiSO4.
解答 解:废渣(除含镍外,还含有Cu、Fe、Cr等杂质),在硫酸溶解过滤后除去不溶于硫酸的铜,所以滤液含有二价铁离子、三价铁离子、三价铬离子杂质,加H2O2是将二价铁氧化成三价铁,再通过调节PH值5.6~8.4使三价铁和三价铬都以氢氧化物的沉淀而除去,滤液Ⅱ含有可溶性硫酸盐,为Na2SO4、NiSO4,再加碳酸钠沉淀二价镍,过滤、洗涤,然后与硫酸反应生成NiSO4.
(1)能提高废渣浸出率即提高反应速率,所以AC都可以提高反应速率,而B增大压强对反应没影响,故选:AC;
(2)因为废渣(除含镍外,还含有Cu、Fe、Cr等杂质),在硫酸溶解过滤后含有二价铁离子、三价铁离子、三价铬离子杂质,所以加H2O2是将二价铁氧化成三价铁,再通过调节PH值5.6~8.4使三价铁和三价铬都以氢氧化物的沉淀而除去,
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O; 5.6≤pH<8.4;Fe3+、Cr3+;
(3)经过加入H2O2、NaOH后可除去Fe、Cr等杂质,滤液中含有可溶性硫酸盐,为Na2SO4、NiSO4,
故答案为:Na2SO4、NiSO4;
(4)检验Ni2+已完全沉淀的实验方法是静置后向上层清液中再加入Na2CO3溶液后没有沉淀生成,
故答案为:静置后向上层清液中再加入Na2CO3溶液后没有沉淀生成;
(5)得到NiCO3沉淀之后应,应先过滤、洗涤,然后与硫酸反应生成NiSO4,所以操作步骤为:①过滤,并用蒸馏水洗涤沉淀2~3次直至流出液用pH试纸检验呈中性;
②向沉淀中加稀H2SO4溶液,直至恰好完全溶解,
故答案为:过滤,并用蒸馏水洗涤沉淀2~3次直至流出液用pH试纸检验呈中性;向沉淀中加稀的H2SO4溶液,直至恰好完全溶解.
点评 本题考查物质的分离提纯的实验方案的设计,题目难度较大,明确实验的目的和原理是解答该题的关键,注意把握基本实验操作.


科目:高中化学 来源: 题型:推断题
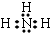 ,B的常见气态氢化物与其最高价氧化物对应的水化物反应产物的阳离子含有共价键、配位键(填化学键的种类),该离子氯化物的水溶液呈酸性,用离子方程式表示为NH4++H2O?NH3•H2O+H+.
,B的常见气态氢化物与其最高价氧化物对应的水化物反应产物的阳离子含有共价键、配位键(填化学键的种类),该离子氯化物的水溶液呈酸性,用离子方程式表示为NH4++H2O?NH3•H2O+H+.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiH4比CH4稳定 | |
| B. | O2-半径比F-的小 | |
| C. | Na和Cs属于第ⅠA族元素,Cs失电子能力比Na的强 | |
| D. | HClO4、H2SO4、H3PO4的酸性依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | Fe(OH)3 | Cu(OH)2 | Ca(OH)2 | Mn(OH)2 | CuS | CaS | MnS | MnCO3 |
| pKsp | 37.4 | 19.32 | 5.26 | 12.7 | 35.2 | 5.86 | 12.6 | 10.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1molNa2O2与水反应转移电子数为0.1 NA | |
| B. | 标准状况下,11.2L HF含有的分子数为0.5 NA | |
| C. | 1mol S在足量O2中燃烧,转移的电子数为6 NA | |
| D. | 7.8g Na2O2固体中所含阴离子数为2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢键是化学键 | |
| B. | 甲烷可与水形成氢键 | |
| C. | 乙醇分子跟水分子之间存在范德华力和氢键 | |
| D. | 碘化氢的沸点比氯化氢的沸点高是由于碘化氢分子之间存在氢键 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
| 18K金成分 | Au | Ag | Cu |
| 含量(质量分数) | 75% | 11.44% | 13.56% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com