
| A. | 5 | B. | 7 | C. | 8 | D. | 9 |
分析 电离度之比等于溶液中水电离的氢氧根离子浓度之比,求出水电离的氢氧根离子浓度,再求出pH.
解答 解:水的电离度之比等于溶液中水电离的氢氧根离子浓度之比,则在0.1mol/L盐酸中水电离的氢氧根离子浓度为10-13mol/L,则0.1mol/LNaR的溶液中水的电离的氢氧根离子浓度为10-12mol/L×108=10-4mol/L,所以0.1mol/LNaR的溶液中c(H+)=$\frac{1{0}^{-13}}{1{0}^{-4}}$=10-9mol/L,所以pH=9;
故选D.
点评 本题考查了盐类的水解、水的电离、溶液PH计算等知识点,试题侧重对学生基础知识的训练和检验,有利于培养学生灵活运用基础知识解决实际问题的能力,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酒精着火时应立即用水灭火 | |
| B. | 实验室制蒸馏水时应在蒸馏烧瓶中放入几粒碎瓷片 | |
| C. | 浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗 | |
| D. | 用试管加热碳酸氢钠固体时使试管口竖直向上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中和10 mL 0.1mol•L-1 醋酸与中和100 mL 0.01mol•L-1 的醋酸所需同种碱溶液的用量不同 | |
| B. | 两种醋酸溶液的物质的量浓度分别c1和c2,pH分别为a和a+1,则c1=10c2 | |
| C. | 常温下,pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色 | |
| D. | 向0.1mol/L的氨水中加入少量硫酸铵固体,则溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
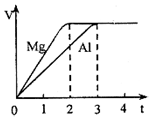
| A. | 物质的量之比为3:2 | B. | 质量之比为3:4 | ||
| C. | 摩尔质量之比为9:8 | D. | 体积之比为2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com