
| A. | 酒精着火时应立即用水灭火 | |
| B. | 实验室制蒸馏水时应在蒸馏烧瓶中放入几粒碎瓷片 | |
| C. | 浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗 | |
| D. | 用试管加热碳酸氢钠固体时使试管口竖直向上 |
分析 A.酒精的密度比水小;
B.蒸馏时应防止液体暴沸;
C.氢氧化钠具有腐蚀性,与硫酸反应放出大量的热;
D.试管口应略向下倾斜.
解答 解:A.用湿抹布盖住酒精,既可以降低温度,又可以使酒精与氧气隔绝,从而达到灭火的目的,故A错误;
B.蒸馏时应防止液体暴沸,可加入碎瓷片,故B正确;
C.浓硫酸溶于水并放热,且具有强腐蚀性,少量浓硫酸沾在皮肤上,应先用干抹布拭去,再用大量的水冲洗,最后涂上碳酸氢钠溶液,故C错误;
D.加热固体时,试管口应略向下倾斜,防止冷凝水回流,试管炸裂,故D错误.
故选B.
点评 本题考查化学实验安全及事故处理,题目难度不大,注意掌握化学实验基本操作方法,明确处理突发事故的方法,确保人身安全、降低国家财产损失.


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:解答题
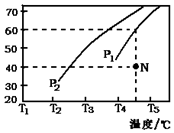
| CO浓度(mol•L-1) | H2浓度(mol•L-1) | 逆反应速率(mol•L-1•min-1) |
| 0.1 | c1 | 9.6 |
| c2 | c1 | 19.2 |
| c2 | 0.3 | 64.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
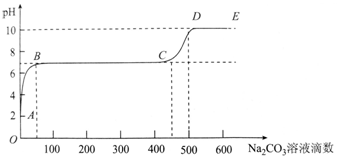
| A. | 开始时溶液pH=2是因为残留液中还有盐酸剩余 | |
| B. | BC段表示随着碳酸钠溶液的滴入,CaCO3沉淀的质量逐渐增加 | |
| C. | 滴入500滴碳酸钠溶液后溶液中c(OH-)>c(H+) | |
| D. | AB发生的反应为:Ca2++CO32-═CaCO3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5 | B. | 7 | C. | 8 | D. | 9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu(OH)2与H2SO4 | B. | Ba(OH)2与H2SO4 | C. | Ba(OH)2与HCl | D. | KHSO4与Ba(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.025 mol/L | B. | 0.30mol/L | C. | 0.36mol/L | D. | 0.45mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/min | n (CO)/mol | n (Cl2)/mol |
| 0 | 1.20 | 0.60 |
| 1 | 0.90 | |
| 2 | 0.20 | |
| 4 | 0.80 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com