
| A. | 0.025 mol/L | B. | 0.30mol/L | C. | 0.36mol/L | D. | 0.45mol/L |
分析 有关反应离子方程式为:3Cu+2NO3-+8H+=3Cu2++2NO(g)+4H2O,由上述反应方程式可知,NO3-和H+的物质的量之比为1:4,氢离子与硝酸根恰好反应,生成的铜离子物质的量最大,设HNO3、H2SO4各为x、ymol,则n(NO3-):n(H+)=x:(x+2y)=1:4,x+y=0.6×0.1,据此计算x、y的值,再根据方程式计算铜离子的物质的量,根据c=$\frac{n}{V}$计算铜离子浓度.
解答 解:反应离子方程式为:3Cu+2NO3-+8H+=3Cu2++2NO(g)+4H2O,铜足量,由上述反应方程式可知,NO3-和H+的物质的量之比为1:4,氢离子与硝酸根恰好反应,生成的铜离子物质的量最大,设HNO3、H2SO4各为x、ymol,则n(NO3-):n(H+)=x:(x+2y)=1:4,x+y=0.6×0.1,联立解得x=0.024mol、y=0.036mol,由方程式可知,生成铜离子的物质的量为0.024mol×$\frac{3}{2}$=0.036mol,故铜离子的最大浓度为$\frac{0.036mol}{0.1L}$=0.36mol/L,
故选C.
点评 本题考查化合物的有关计算,确定NO3-和H+的物质的量之比为1:4时生成的铜离子浓度最大是解题的关键,难度中等,注意利用离子方程式进行解答.


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酒精着火时应立即用水灭火 | |
| B. | 实验室制蒸馏水时应在蒸馏烧瓶中放入几粒碎瓷片 | |
| C. | 浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗 | |
| D. | 用试管加热碳酸氢钠固体时使试管口竖直向上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
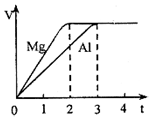
| A. | 物质的量之比为3:2 | B. | 质量之比为3:4 | ||
| C. | 摩尔质量之比为9:8 | D. | 体积之比为2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
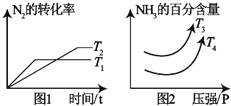 硝酸工业是国民经济的命脉产业,工业制硝酸通常是如下过程:
硝酸工业是国民经济的命脉产业,工业制硝酸通常是如下过程:| 化学键 | N≡N | H-H | N-H |
| 键能/kJ/mol | a | b | c |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com