
| A. | 物质的量之比为3:2 | B. | 质量之比为3:4 | ||
| C. | 摩尔质量之比为9:8 | D. | 体积之比为2:3 |
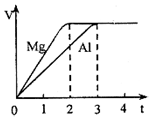
分析 根据图象可知,两种金属得到的氢气一样多,然后根据金属镁、铝和足量的稀硫酸反应的化学方程式:Mg+H2SO4=MgSO4+H2↑,2Al+3H2SO4=Al2(SO4)3+3H2↑,即可找出各个量之间的关系.
解答 解:A、由于Mg~H2,2Al~3H2,且两种金属得到的氢气一样多,因此镁和铝的物质的量的比是1:$\frac{2}{3}$=3:2,故A正确;
B、由于Mg~H2,2Al~3H2,且两种金属得到的氢气一样多,因此镁和铝的物质的量的比是1:$\frac{2}{3}$=3:2,则它们的质量的比为(3×24):(2×27)=4:3,故B错误;
C、镁和铝的摩尔质量之比和该化学反应毫无关系,即它们的摩尔质量之比为24g/mol:27g/mol=8:9,故C错误;
D、根据B的分析,金属镁和铝的质量的比为(3×24):(2×27)=4:3,体积等于质量和密度之比,所以金属的体积之比还得借助密度数据计算,故D错误;
故选A.
点评 本题以图象形式考查混合物计算、金属与酸的反应,侧重考查学生分析计算能力,明确反应方程式中各个物理量之间的关系是解本题关键,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
| 共价键 | H-H | N≡N | N-H |
| 键能(kJ•mol-1) | 436 | 945 | 391 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5 | B. | 7 | C. | 8 | D. | 9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu(OH)2与H2SO4 | B. | Ba(OH)2与H2SO4 | C. | Ba(OH)2与HCl | D. | KHSO4与Ba(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 植物油 | B. | 馒头 | C. | 牛肉 | D. | 橙子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.025 mol/L | B. | 0.30mol/L | C. | 0.36mol/L | D. | 0.45mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 向大气中排放过量的二氧化碳是造成全球气候变暖的重要因素,所以二氧化碳的捕捉和利用是我国能源领域的一个重要战略方向.
向大气中排放过量的二氧化碳是造成全球气候变暖的重要因素,所以二氧化碳的捕捉和利用是我国能源领域的一个重要战略方向. ;将足量的C02通入下列溶液中,最终溶液变浑浊的是ce.
;将足量的C02通入下列溶液中,最终溶液变浑浊的是ce.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com