
����Ŀ��ij����С��������ij��������Ʒ���Ƿ����������ƣ���Ʒ������£�ȡ�������������Һ������Һ�еμ���������KMnO4��Һ���۲���Һ�Ƿ���ɫ�������Һ��ɫ��ȥ��˵������Ʒ�к����������ƣ� 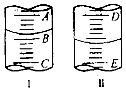
��1�������ӷ���ʽ��ʾ�÷�Ӧԭ���� ��
��2��ͼI��ʾ100mL��Ͳ��Һ���λ�ã�A��B��B��C�̶ȼ����10mL������̶�AΪ30����Ͳ��Һ��������mL��ͼII��ʾ25mL�ζ�����Һ���λ�ã����Һ�洦�Ķ�����a����ζ�����Һ������������ĸ��
A������amL B�����ڣ�25��a��mL C������amL D�����ڣ�25��a��mL
��3����С��ͬѧ���ⶨ��Ʒ���������Ƶĺ����������������£�
a����ȡmg��Ʒ��������ˮ�ܽⲢ������ƿ��
b����V1mL C1mol/L������KMnO4��Һ��������������ƿ����
c����C2mol/L�����ƣ�Na2C2O4����Һ�ζ�������KMnO4 �� ���ζ��յ�ʱ��ȥNa2C2O4��ҺV2mL
��KMnO4��ҺӦװ��ʽ�ζ����У��ﵽ�ζ��յ�ʱ��Һ��ɫ�ı仯 ��
����Ʒ��Na2SO3�����ʵ���Ϊmol�����ú�C1��V1��C2��V2�Ĵ���ʽ��ʾ����
��4�����в����ᵼ�²�õ�Na2SO3�����ʵ���ƫ�ߵ���������ĸ��˫ѡ����
A.δ��Na2C2O4��Һ��ϴ�ζ���
B.�ζ�ǰ����ʢ��Na2C2O4��Һ�ĵζ��ܣ��ζ�����
C.�ζ�ǰ�ζ��ܼ��촦�����ݣ��ζ�����ʧ
D.�ζ�ʱҡ����ƿ��ƿ�е�Һ�ν�����
���𰸡�
��1��5SO32��+2MnO4��+6H+=5SO42��+2Mn2++3H2O
��2��22.0��D
��3�����ɫ��ȥ�Ұ���Ӳ��ָ���10��3����2.5C1V1��C2V2��
��4��BD
���������⣺��1���÷�Ӧԭ��Ϊ����KMnO4��Һ��ǿ�����Խ��������������������ƣ���KMnO4��Һ����ԭ�������ӣ����ӷ���ʽΪ��5SO32��+2MnO4��+6H+=5SO42��+2Mn2++3H2O�����Դ��ǣ�5SO32��+2MnO4��+6H+=5SO42��+2Mn2++3H2O����2����ͲС�̶����£�A��B��B��C�̶ȼ����10mL���̶�AΪ30����̶�BΪ20��AB��ÿһС��Ϊ2mL������Ͳ��Һ������Ϊ22.0mL���ζ��̶ܿ�0�̶����ϣ����ϵ�������ͼ���ʾ25mL�ζ�����Һ���λ�ã����Һ�洦�Ķ�����a�������̶�����û�п̶ȣ���ζ�����Һ������һ�����ڣ�25��a�� mL��
���Դ��ǣ�22.0��D����3����KMnO4��Һ����ǿ�����ԣ����Ը�ʴ��Ƥ�ܣ���KMnO4��ҺӦװ����ʽ�ζ����У�KMnO4��Һ����ɫ���������һ��Na2C2O4��Һ����ɫ��ȥ��˵���ζ����յ㣬���Դ��ǣ����ɫ��ȥ�Ұ���Ӳ��ָ���
����C2mol/L�����ƣ�Na2C2O4����Һ�ζ�������KMnO4 �� ���ζ��յ�ʱ��ȥNa2C2O4��ҺV2mL�����ݵ�ʧ�����غ㣬��ʣ�����������ʵ���Ϊ ![]() mol������������������Һ��Ӧ���ĵĸ��������ҺΪC1V1��10��3mol��
mol������������������Һ��Ӧ���ĵĸ��������ҺΪC1V1��10��3mol�� ![]() mol�����ݷ�Ӧ�����ӷ���ʽ��
mol�����ݷ�Ӧ�����ӷ���ʽ��
2MnO4��+ | 5SO32��+ | 6H+ | = | 2Mn2++ | 5SO42��+ | 3H2O |
2 | 5 |
C1V1��10��3mol�� ![]() mol
mol ![]() ����C1V1��10��3mol��
����C1V1��10��3mol�� ![]() mol��=10��3����2.5C1V1��C2V2��mol
mol��=10��3����2.5C1V1��C2V2��mol
���Դ��ǣ�10��3����2.5C1V1��C2V2������4��A��δ��Na2C2O4��Һ��ϴ�ζ��ܣ����µζ�ʱ����Na2C2O4���ƫ�����Լ����ʣ�����������ʵ���Ҳ��ƫ����������������ӷ�Ӧ�ĸ������ƫС�����²�õ�Na2SO3�����ʵ���ƫС����A����
B���ζ�ǰ����ʢ��Na2C2O4��Һ�ĵζ��ܣ��ζ����ӣ����µζ�ʱ����Na2C2O4���ƫС�����Լ����ʣ�����������ʵ���Ҳ��ƫС����������������ӷ�Ӧ�ĸ������ƫ���²�õ�Na2SO3�����ʵ���ƫ��B��ȷ��
C���ζ�ǰ�ζ��ܼ��촦�����ݣ��ζ�����ʧ�����µζ�ʱ����Na2C2O4���ƫ�����Լ����ʣ�����������ʵ���Ҳ��ƫ����������������ӷ�Ӧ�ĸ������ƫС�����²�õ�Na2SO3�����ʵ���ƫС����C����
D���ζ�ʱҡ����ƿ��ƿ�е�Һ�ν��������µζ�ʱ����Na2C2O4���ƫС�����Լ����ʣ�����������ʵ���Ҳ��ƫС����������������ӷ�Ӧ�ĸ������ƫ���²�õ�Na2SO3�����ʵ���ƫ��B��ȷ��
��ѡ��BD��


 ����ѧУ�ֲ����ܲ�ϵ�д�
����ѧУ�ֲ����ܲ�ϵ�д� �ƸԺ���ȫ�����Ų��Ծ�ϵ�д�
�ƸԺ���ȫ�����Ų��Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����H3O+������ͬ�������͵������������ǣ� ��
A. F�DB. C1�DC. NH3D. Na+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͭ������ϡ���ᷴӦ��ȴ����Ũ���ᷴӦ����Ӧ�ķ���ʽΪ��Cu+2H2SO4��Ũ��=CuSO4+2H2O+SO2��
��ش�
��1������1molͭ��Ӧ������뻹ԭ��Ӧ��H2SO4���ʵ���Ϊ ��
��2������12.8gͭ��������Ũ���ᷴӦ�������ɱ�״����SO2������Ƕ���������д��������̣�
��3������100mL 18.4mol/L��Ũ������������ͭ��Ӧ��ȴ���ܵõ�0.92mol��SO2 �� ԭ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ҫ��ش��������⣺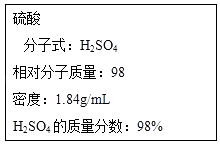
��ͼΪʵ����ijŨ�����Լ�ƿ�ı�ǩ���Ը��ݱ�ǩ�ϵ��й����ݻش��������⣺
��1����Ũ������H2SO4�����ʵ���Ũ��Ϊ
��2��ijѧ����������Ũ���������ˮ����250mL���ʵ���Ũ��Ϊ0.4molL��1��ϡ���ᣬ��ѧ����Ҫ��ȡ����Ũ����������ƣ�
��3��Ϊ���ƣ�2���е�ϡ���ᣬ���пɹ�ѡ�õ������У�һ���õ����������ţ������ƹ����л�ȱ�ٵ�����������д�������ƣ�
�ٲ��������ڽ�ͷ�ιܣ�����Ͳ����ҩ�ף���Բ����ƿ������ƽ�����ձ�������ͨ©��
��4��ȡ�������ƺõ�������Һ50mL������������Ӧ��������Һ��c��Al3+��=��������Һ����ı仯����������Һ��SO42�����ڵķ����� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ȼ�������е�����������������ԭ��Ӧ����
A.����������������Ⱦ���γ�����B.ֲ����й������
C.��Ư�۾�ɱ��D.������ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1LK2SO4��CuSO4�Ļ����Һ�У�C��SO42����=2molL��1 �� ��ʯī���缫������Һ����ͨ��һ��ʱ����������ռ���22.4L����������壬��ԭ��Һ��k+�����ʵ���Ũ��Ϊ�� ��
A.2molL��1
B.3 molL��1
C.1molL��1
D.0.5 molL��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��
CH3CH2CH2CH3��g��+ ![]() O2��g���T4CO2��g��+5H2O��l����H=��2 878kJ/mol
O2��g���T4CO2��g��+5H2O��l����H=��2 878kJ/mol
��CH3��2CHCH3��g��+ ![]() O2��g���T4CO2��g��+5H2O��l����H=��2 869kJ/mol
O2��g���T4CO2��g��+5H2O��l����H=��2 869kJ/mol
����˵����ȷ���ǣ� ��
A.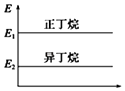
���������춡���������С��ϵ��ͼ
B.��������ȶ��Դ����춡��
C.�춡��ת��Ϊ������Ĺ�����һ�����ȹ���
D.�춡������е�̼�����������Ķ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CO�ǻ������糧�ͷų�����Ҫβ����Ϊ���ٶԻ�����Ⱦ�����糧��ͼ����CO��Cl2�ڴ����������ºϳɹ�����COCl2����ij�¶��£���2L���ܱ�������Ͷ��һ������CO��Cl2 �� �ڴ����������·�����Ӧ��CO��g��+Cl2��g��COCl2��g����H=a kJ/mol
��Ӧ�����вⶨ�IJ������������
t/min | n ��CO��/mol | n ��Cl2��/mol |
0 | 1.20 | 0.60 |
1 | 0.90 | |
2 | 0.80 | |
4 | 0.20 |
��1���Ƚϸ�ʱ��ƽ������v��COCl2����v��0��1��v��0��2����v��0��2��v��1��2�� �����������=����������
��2����2min��4min�䣬v��Cl2����v��Cl2���� �����������=�������������¶���K=
��3����֪X��L�ɷֱ�����¶Ȼ�ѹǿ����ͼ��ʾLһ��ʱ��CO��ש������X�ı仯��ϵ��
X����������������a0 �����������=��������������������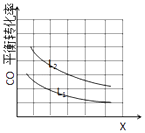
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��X��Y��Z��W��Ԫ�����ڱ��е����λ����ͼ��ʾ������Wԭ�ӵ���������������������������������˵������ȷ���ǣ� �� 
A.ԭ�Ӱ뾶��Z��W��X��Y
B.����������Ӧˮ��������ԣ�X��W��Z
C.�����̬�⻯������ȶ��ԣ�Y��X��W��Z
D.ZY2�����ۻ���Һ̬Y3��������˷����Ӽ�������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com