
【题目】有机物的结构可用“键线式”表示,如CH3—CH=CH—CH3可简写为![]() ,有机物X的键线式为
,有机物X的键线式为![]() 。下列说法中不正确的是( )
。下列说法中不正确的是( )
A.X的分子式为C8H8
B.有机物Y是X的同分异构体,且属于芳香烃,则Y的结构简式为![]()
C.X能使KMnO4酸性溶液褪色
D.X与足量的H2在一定条件下反应可生成环状的饱和烃Z,Z的一氯化物有4种
 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:
【题目】在2 L密闭容器内,800 ℃时反应:2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.011 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)写出该反应的平衡常数表达式:K= 。
(2)如图中表示NO2的变化的曲线是 。用O2表示从0~2s内该反应的平均速率v=

(3)能说明该反应已达到平衡状态的是 。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆 (NO)=2v正 (O2) d.容器内密度保持不变
(4)某同学查阅资料得知,该反应![]() >
>![]() ;25 ℃时,生成1 mol NO2,热量变化为56.4 kJ。但是该同学由于疏忽,忘记注明“+”、“-”。根据题目信息,该反应的热化学方程式为 。
;25 ℃时,生成1 mol NO2,热量变化为56.4 kJ。但是该同学由于疏忽,忘记注明“+”、“-”。根据题目信息,该反应的热化学方程式为 。
(5)为使该反应的反应速率增大,且平衡向正反应方向移动的是 。
a.及时分离除NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T ℃时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g) ![]() PCl3(g)+Cl2(g)经过一段时间后达到平衡,反应过程中测定的部分数据如图所示。下列说法正确的是
PCl3(g)+Cl2(g)经过一段时间后达到平衡,反应过程中测定的部分数据如图所示。下列说法正确的是
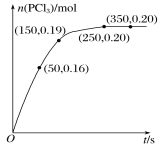
A.反应在前50 s的平均速率v(PCl3)=0.0032 mol·L-1·s-1
B.相同温度下,起始时向容器中充入2.0 mol PCl3和2.0 mol Cl2,达到平衡时,PCl3的转化率小于80%
C.T ℃时,该反应的化学平衡常数K=0.025
D.相同温度下,起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3 和0.20 mol Cl2,反应达到平衡前v正>v逆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2是一种廉价的碳资源,综合利用CO2对构建低碳社会有重要意义。
(1)已知: H2(g)+ ![]() O2(g) =H2O(g) ΔH=-241.8kJ·mol-1 CO2(g) = CO(g)+
O2(g) =H2O(g) ΔH=-241.8kJ·mol-1 CO2(g) = CO(g)+ ![]() O2(g) ΔH=+283.0kJ·mol-1 则反应:CO2(g)+H2O(g) =CO(g)+H2(g)+O2(g) ΔH=________。
O2(g) ΔH=+283.0kJ·mol-1 则反应:CO2(g)+H2O(g) =CO(g)+H2(g)+O2(g) ΔH=________。
(2)工业生产中可利用H2还原CO2制备清洁能源甲醇:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH<0
CH3OH(g)+H2O(g) ΔH<0
①保持温度、体积一定,能说明上述反应达到平衡状态的是_________。
A.容器内压强不变 B.3v正 (CH3OH)= v正 (H2)
C.容器内气体的密度不变 D.CO2与H2O的物质的量之比保持不变
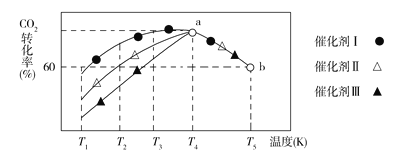
②将一定量的CO2和H2充入到某恒容密闭容器中,测得在不同催化剂作用下,相同时间内CO2的转化率随温度的变化如图所示,催化效果最好的是催化剂________(填“Ⅰ”“Ⅱ”或“Ⅲ”),该反应在a点达到平衡状态,a点的转化率比b点的高,其原因是________。
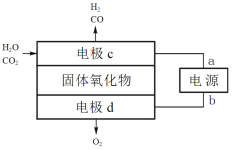
(3)固体氧化物电解池(SOEC)可用于高温电解CO2/H2O,既可高效制备合成气(CO和H2),又可实现CO2的减排,其工作原理如图。
①电源正极为________(填“a”或“b”),电极c上发生的电极反应式为________、_____。
②阴阳两极生成的气体的物质的量之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学中常用图像直观地描述化学反应的进程或结果。下列图像描述正确的是( )
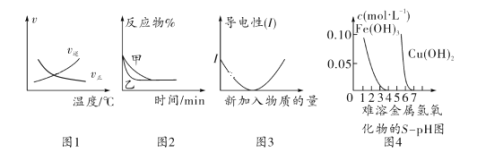
A.根据图1可判断可逆反应“A2(g)+3B2(g)![]() 2AB3(g)”的 ΔH<0
2AB3(g)”的 ΔH<0
B.图2可能表示压强对可逆反应2A(g)+2B(g)![]() 3C(g)+D(s)的影响,乙的压强大
3C(g)+D(s)的影响,乙的压强大
C.图3可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化
D.根据图4,若除去CuSO4溶液中的Fe3+可采用向溶液中加入适量Cu至pH在4左右
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓度均为0.1 mol/L、体积均为V0的HX、HY溶液,分别加水稀释至体积V,pH随![]() 的变化关系如图所示。下列叙述正确的是
的变化关系如图所示。下列叙述正确的是

A.HX、HY都是弱酸,且HX的酸性比HY的弱
B.常温下,由水电离出的c(H+)·c(OH -):a<b
C.相同温度下,电离常数K( HX):a>b
D.![]() =3,若同时微热两种溶液(不考虑HX 、HY和H2O的挥发),则
=3,若同时微热两种溶液(不考虑HX 、HY和H2O的挥发),则![]() 减小
减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中,A是氯气的发生装置,B、C是净化气体的装置,D中装铁丝网;反应后E的底部有棕色固体聚集;F是吸收多余气体的装置。

(1)上述装置中有一处错误,请指出是______处(用字母表示)。
(2)通过F是为了除去_____________。
(3)写出D中发生反应的化学方程式_______。
(4)如果A中产生氯气3.36L(标准状况) [A中的反应为(MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O)]。请计算:。
MnCl2+Cl2↑+2H2O)]。请计算:。
①消耗MnO2的物质的量__________。②被氧化的HCl的物质的量____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳及其化合物广泛存在于自然界。请回答下列问题:
(1)反应Ⅰ:Fe(s)+CO2(g) ![]() FeO(s)+CO(g) ΔH1 平衡常数为K1
FeO(s)+CO(g) ΔH1 平衡常数为K1
反应Ⅱ:Fe(s)+H2O(g) ![]() FeO(s)+H2(g) ΔH2 平衡常数为K2
FeO(s)+H2(g) ΔH2 平衡常数为K2
不同温度下,K1、K2的值如下表:
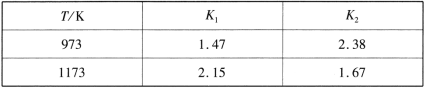
现有反应Ⅲ:H2(g)+CO2(g) ![]() CO(g)+H2O(g),结合上表数据,反应Ⅲ是_______ (填“放热”或“吸热”)反应。
CO(g)+H2O(g),结合上表数据,反应Ⅲ是_______ (填“放热”或“吸热”)反应。
(2)已知CO2催化加氢合成乙醇的反应原理为:
2CO2(g)+6H2(g) ![]() C2H5OH(g)+3H2O(g) H<0。
C2H5OH(g)+3H2O(g) H<0。
设m为起始时的投料比,即m= n(H2)/ n(CO2)。
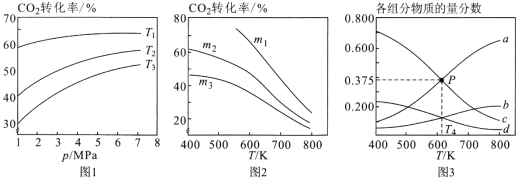
①图1中投料比相同,温度从高到低的顺序为______________________。
②图2中m1、m2、m3从大到小的顺序为________________________。
③图3表示在总压为5MPa的恒压条件下,且m=3时,平衡状态时各物质的物质的量分数与温度的关系。则曲线d代表的物质化学名称为______________,T4温度时,该反应平衡常数KP的计算式为(不必化简)_______________________。
(3)已知:NH3·H2O的Kb=1.7×10-5,H2CO3的Ka1=4.3×10-7、Ka2=5.6×10-11。工业生产尾气中的CO2捕获技术之一是氨水溶液吸收技术,工艺流程是将烟气冷却至15.5℃~26.5℃后用氨水吸收过量的CO2。所得溶液的pH___________7(填“>”、“=”或“<”)。烟气需冷却至15.5℃~26.5℃的可能原因是____________。
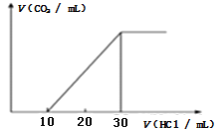
(4)为了测量某湖水中无机碳含量,量取100mL湖水,酸化后用N2吹出CO2,再用NaOH溶液吸收。往吸收液中滴加1.0mol/L盐酸,生成的V(CO2)随V(盐酸)变化关系如图所示,则原吸收液中离子浓度由大到小的顺序为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com