
【题目】CO2是一种廉价的碳资源,综合利用CO2对构建低碳社会有重要意义。
(1)已知: H2(g)+ ![]() O2(g) =H2O(g) ΔH=-241.8kJ·mol-1 CO2(g) = CO(g)+
O2(g) =H2O(g) ΔH=-241.8kJ·mol-1 CO2(g) = CO(g)+ ![]() O2(g) ΔH=+283.0kJ·mol-1 则反应:CO2(g)+H2O(g) =CO(g)+H2(g)+O2(g) ΔH=________。
O2(g) ΔH=+283.0kJ·mol-1 则反应:CO2(g)+H2O(g) =CO(g)+H2(g)+O2(g) ΔH=________。
(2)工业生产中可利用H2还原CO2制备清洁能源甲醇:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH<0
CH3OH(g)+H2O(g) ΔH<0
①保持温度、体积一定,能说明上述反应达到平衡状态的是_________。
A.容器内压强不变 B.3v正 (CH3OH)= v正 (H2)
C.容器内气体的密度不变 D.CO2与H2O的物质的量之比保持不变
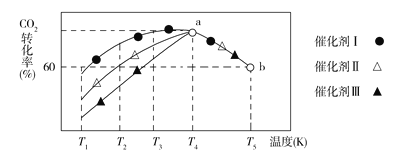
②将一定量的CO2和H2充入到某恒容密闭容器中,测得在不同催化剂作用下,相同时间内CO2的转化率随温度的变化如图所示,催化效果最好的是催化剂________(填“Ⅰ”“Ⅱ”或“Ⅲ”),该反应在a点达到平衡状态,a点的转化率比b点的高,其原因是________。
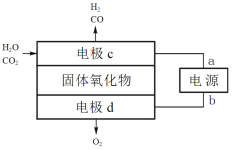
(3)固体氧化物电解池(SOEC)可用于高温电解CO2/H2O,既可高效制备合成气(CO和H2),又可实现CO2的减排,其工作原理如图。
①电源正极为________(填“a”或“b”),电极c上发生的电极反应式为________、_____。
②阴阳两极生成的气体的物质的量之比为________。
【答案】+524.8kJ·mol-1 AD Ⅰ 该反应为放热反应,达平衡后,随温度升高,平衡逆向移动,CO2的转化率降低 b H2O+2e-=H2↑+O2- CO2+2e-=CO+O2- 2:1
【解析】
(1)根据盖斯定律进行分析计算;
(2)①根据平衡状态判断标准进行v正= v逆,各组分的浓度及由此引出相关的物质的量的变化情况进行分析;
②从图中看,相同温度下,Ⅰ 中CO2的转化率最大,说明反应速率最快,催化效果最好;该反应在a点达到平衡状态,a点的转化率比b点的高,说明继续升高温度,平衡逆向移动,从而得出其原因是该反应为放热反应,据此进行分析;
(3)①从图中看出,H2O、CO2在c电极转化为H2、CO,说明此电极为阳极,则与之相连的a电极为负极,电源正极为b;电极c为电解池的阴极,发生还原反应;
②阳极的电极反应为2O2—4e- =O2↑,根据电子得失守恒规律,计算出阴阳两极生成的气体的物质的量之比。
(1)H2(g)+ ![]() O2(g) =H2O(g) ΔH=-241.8kJ·mol-1 ①
O2(g) =H2O(g) ΔH=-241.8kJ·mol-1 ①
CO2(g) = CO(g)+ ![]() O2(g) ΔH=+283.0kJ·mol-1 ②
O2(g) ΔH=+283.0kJ·mol-1 ②
根据盖斯定律将②-①得:CO2(g)+H2O(g) =CO(g)+H2(g)+O2(g) ΔH= +524.8kJ·mol-1;
答案为:+524.8kJ·mol-1;
(2)①A.因为反应前后气体分子数不等,所以容器内压强不变时,反应达平衡状态,A符合题意;
B.3v正(CH3OH)= v正(H2),反应向同一方向进行,不一定是平衡状态,B不正确;
C.因为气体的质量不变,容器的容积不变,所以容器内气体的密度始终不变,C不正确;
D.CO2与H2O的物质的量之比保持不变,则平衡不发生移动,D达平衡状态,符合题意;
故选AD;
②从图中看,相同温度下,Ⅰ 中CO2的转化率最大,说明反应速率最快,催化效果最好;
该反应在a点达到平衡状态,a点的转化率比b点的高,说明继续升高温度,平衡逆向移动,从而得出其原因是该反应为放热反应,达平衡后,随温度升高,平衡逆向移动,CO2的转化率降低;
答案为:Ⅰ;该反应为放热反应,达平衡后,随温度升高,平衡逆向移动,CO2的转化率降低;
(3)①从图中看出,H2O、CO2在c电极转化为H2、CO,说明此电极为阳极,则与之相连的a电极为负极,电源正极为b;电极c上发生的电极反应式为H2O+2e-=H2↑+O2-、CO2+2e-=CO+O2-;
答案为:b;H2O+2e-=H2↑+O2-、CO2+2e-=CO+O2-;
②阳极的电极反应为2O2—4e- =O2↑,按得失电子总数相等的原则,设电路中通过4mole-,则阳极生成1molO2,阴极生成2molH2,或2molCO,或2mol二者的混合气,从而得出阴阳两极生成的气体的物质的量之比为2:1;
答案为2:1。


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:
【题目】合成氨工业对国民经济和社会发展具有重要的意义。 合成塔中发生反应为: N2(g)+3H2(g)![]() 2NH3(g) △H<0
2NH3(g) △H<0
(1)工业生产时,制取氢气的一个反应为:CO(g)+H2O(g)![]() CO2(g)+H2(g) △H>0
CO2(g)+H2(g) △H>0
①t℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。
该温度下此反应的平衡常数K =__________________________。
②保持温度不变,向上述平衡体系中再加入0.1mol CO,当反应重新建立平衡时,水蒸气的总转化率α (H2O)__________。
(2)下表为不同温度下合成氨反应的平衡常数。由表可推知T1_____573K(填“>”、“<”或“=”)。
T/K | T1 | 573 | T2 |
K | 1.00×107 | 2.45×105 | 1.88×103 |
(3)673K,30MPa下n(NH3) 和n(H2) 随时间变化的关系如下图所示依据上图,下列有关叙述正确的是(填写序号)_________________。

A.c点表示n(NH3)和n (H2)相等
B.c点表示NH3生成速率与NH3分解速率相同
C.e点和d点时反应的平衡常数相同
D.c点时正反应速率大于逆反应速率
(4)用NO2溶于水制硝酸:3NO2+H2O![]() 2HNO3+NO。从生产流程看,吸收塔中需
2HNO3+NO。从生产流程看,吸收塔中需
要补充空气,其原因用化学平衡移动的理论进行解释是______________。
(5)硝酸厂的尾气含有氮氧化物,不经处理直接排放将污染空气。目前科学家探索
利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g); △H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g); △H=-1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化钡广泛用于玻璃、陶瓷工业,是制取过氧化钡和钡盐的原料。一种利用钡泥[含BaCO3、BaSO3、Ba(FeO2)2等]制取氧化钡的绿色工艺流程如下:
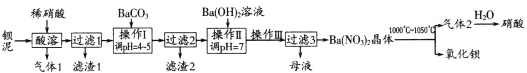
回答下列问题:
(1)酸溶时,Ba(FeO2)2与稀硝酸反应的化学方程式为_____________________。
(2)产生滤渣1的反应离子方程式是____________________________________________。
(3)操作Ⅰ调pH=4~5的目的是_________________________________________________。
(4)过滤3所得母液应返回______________工序循环使用。
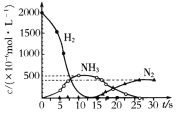
(5)Ba(NO3)2可用于汽车尾气中还原性气体的催化转化。科技工作者用H2模拟尾气中的还原性气体,研究Ba(NO3)2的催化还原过程。该过程分两步进行,如图表示该过程相关物质浓度随时间的变化关系。第二步反应消耗的NH3与NO3-的物质的量之比是_________。
(6)“气体2”为混合气体。标准状况下a L“气体2”溶于水得到bL溶液,则所得溶液的物质的量浓度为_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)6.4gM和17.0gN恰好完全反应,生成0.4molX和12.2gY,则X的摩尔质量为:___。
(2)实验室需要制备22.4L(标准状况)H2,现用质量分数为90.0%的锌粒与足量的稀盐酸反应(假设杂质不与稀盐酸反应),问:(要求写出计算过程)
①至少需要质量分数为90.0%的锌粒多少克?___
②生成的氯化锌的物质的量是多少?___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求填空:
(1)写出有机物![]() 的名称________。
的名称________。
(2)当乙酸分子中的O都是18O时,乙醇分子中的O都是16O时,二者在一定条件下反应,生成物中水的相对分子质量为______。
(3)化学与生活息息相关。下列叙述正确的是___(填字母代号)。
A.馒头越嚼越甜 B.鲜榨橙汁遇到碘水会变蓝
C.油脂经水解可变成葡糖糖 D.土豆中的淀粉经水解可变成酒
(4)某化合物C3H6O2的核磁共振谱(NMR)中有3个峰,其强度比为3∶2∶1,则该化合物的结构简式可能为_______(写出一种即可)。
(5)瑞香素是一种具有抗菌、抗炎、抗凝血等生物活性的香豆素化合物,其分子结构如图所示。回答下列问题。
![]()
①瑞香素的化学式为____,含氧官能团名称____;
②1mol此化合物可与______molBr2反应,最多可以与____molNaOH反应。
(6)甲醛和新制氢氧化铜的反应显示了甲醛的还原性,发生反应的化学方程式通常表示为HCHO+2Cu(OH)2+NaOH![]() HCOONa+Cu2O↓+3H2O。若向足量新制氢氧化铜中加入4.00mL甲醛水溶液,充分反应。请设计一个简单实验验证甲醛的氧化产物不是甲酸盐。____。(可供选用的试剂:硫酸铜溶液、甲醛、甲酸、氢氧化钠溶液。)
HCOONa+Cu2O↓+3H2O。若向足量新制氢氧化铜中加入4.00mL甲醛水溶液,充分反应。请设计一个简单实验验证甲醛的氧化产物不是甲酸盐。____。(可供选用的试剂:硫酸铜溶液、甲醛、甲酸、氢氧化钠溶液。)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物的结构可用“键线式”表示,如CH3—CH=CH—CH3可简写为![]() ,有机物X的键线式为
,有机物X的键线式为![]() 。下列说法中不正确的是( )
。下列说法中不正确的是( )
A.X的分子式为C8H8
B.有机物Y是X的同分异构体,且属于芳香烃,则Y的结构简式为![]()
C.X能使KMnO4酸性溶液褪色
D.X与足量的H2在一定条件下反应可生成环状的饱和烃Z,Z的一氯化物有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时有关弱酸的电离平衡常数:则下列有关说法正确的是( )
弱酸化学式 | CH3COOH | HCN | H2CO3 |
电离平衡常数 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
A. 等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa)
B. 冰醋酸中逐滴加水,则溶液的导电性、醋酸的电离程度、pH均先增大后减小
C. NaCN中通入少量CO2发生的化学反应为:NaCN+CO2+H2O=HCN+NaHCO3
D. 稀释HCN溶液过程中,![]() 减小
减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
回答下列问题:
(1)Z元素在周期表中的位置为___。
(2)下列事实能说明Y元素的非金属性比S元素的非金属性强的是___;
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1molS得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(3)X与Z两元素的单质反应生成1molX的最高价化合物,恢复至室温,放热687kJ,已知该化合物的熔、沸点分别为-69℃和58℃,写出该反应的热化学方程式___。
(4)碳与镁形成的1mol化合物Q与水反应,生成2molMg(OH)2和1mol烃,该烃分子中碳氢质量比为9:1,烃的电子式为___。Q与水反应的化学方程式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】结合图回答问题:如图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
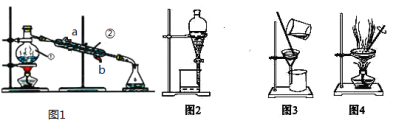
(1)写出上述装置中仪器的名称:①________。
(2)若利用上述装置分离乙酸(沸点118℃)和乙酸乙酯(沸点77.1℃)的混合物,还缺少的仪器有________,图1中仪器 ②是从______口进水(填a或b)。
(3)图2在分液时为使液体顺利滴下,除打开活塞外,还应进行的具体操作是______
(4)从氯化钾溶液中得到氯化钾固体,选择装置______(填代表装置图的序号,下同);除去自来水中的Cl等杂质,选择装置______。
(5)实验室常用上述装置分离碘水中的碘,进行该操作时,需在碘水中加一试剂,在选择试剂时,下列性质你认为哪些性质是必需的:________(填序号)。
①常温下为液态 ②I2在其中溶解程度大 ③与水互不相容 ④密度要比水大。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com