
【题目】碳及其化合物广泛存在于自然界。请回答下列问题:
(1)反应Ⅰ:Fe(s)+CO2(g) ![]() FeO(s)+CO(g) ΔH1 平衡常数为K1
FeO(s)+CO(g) ΔH1 平衡常数为K1
反应Ⅱ:Fe(s)+H2O(g) ![]() FeO(s)+H2(g) ΔH2 平衡常数为K2
FeO(s)+H2(g) ΔH2 平衡常数为K2
不同温度下,K1、K2的值如下表:
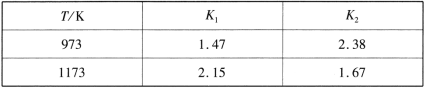
现有反应Ⅲ:H2(g)+CO2(g) ![]() CO(g)+H2O(g),结合上表数据,反应Ⅲ是_______ (填“放热”或“吸热”)反应。
CO(g)+H2O(g),结合上表数据,反应Ⅲ是_______ (填“放热”或“吸热”)反应。
(2)已知CO2催化加氢合成乙醇的反应原理为:
2CO2(g)+6H2(g) ![]() C2H5OH(g)+3H2O(g) H<0。
C2H5OH(g)+3H2O(g) H<0。
设m为起始时的投料比,即m= n(H2)/ n(CO2)。
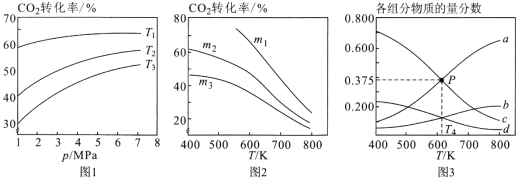
①图1中投料比相同,温度从高到低的顺序为______________________。
②图2中m1、m2、m3从大到小的顺序为________________________。
③图3表示在总压为5MPa的恒压条件下,且m=3时,平衡状态时各物质的物质的量分数与温度的关系。则曲线d代表的物质化学名称为______________,T4温度时,该反应平衡常数KP的计算式为(不必化简)_______________________。
(3)已知:NH3·H2O的Kb=1.7×10-5,H2CO3的Ka1=4.3×10-7、Ka2=5.6×10-11。工业生产尾气中的CO2捕获技术之一是氨水溶液吸收技术,工艺流程是将烟气冷却至15.5℃~26.5℃后用氨水吸收过量的CO2。所得溶液的pH___________7(填“>”、“=”或“<”)。烟气需冷却至15.5℃~26.5℃的可能原因是____________。
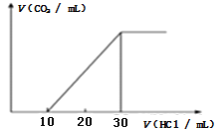
(4)为了测量某湖水中无机碳含量,量取100mL湖水,酸化后用N2吹出CO2,再用NaOH溶液吸收。往吸收液中滴加1.0mol/L盐酸,生成的V(CO2)随V(盐酸)变化关系如图所示,则原吸收液中离子浓度由大到小的顺序为__________。
【答案】吸热 ![]()
![]() 乙醇
乙醇 ![]() > 降低吸收过程中氨水的挥发,促进氨水对CO2的吸收 c(Na+)> c(HCO3-) > c(CO32-) > c(OH-) > c(H+)
> 降低吸收过程中氨水的挥发,促进氨水对CO2的吸收 c(Na+)> c(HCO3-) > c(CO32-) > c(OH-) > c(H+)
【解析】
(1)由图可知反应①的K1随温度升高而增大,说明正反应为吸热反应,△H>0,反应②的K2随温度升高而减小,说明正反应为放热反应,△H<0,已知:①Fe(s)+CO2(g)![]() FeO(s)+CO(g)△H1=Q1>0,②Fe(s)+H2O(g)
FeO(s)+CO(g)△H1=Q1>0,②Fe(s)+H2O(g)![]() FeO(s)+H2(g)△H2=Q2<0,由盖斯定律①-②得③H2(g)+CO2(g)
FeO(s)+H2(g)△H2=Q2<0,由盖斯定律①-②得③H2(g)+CO2(g)![]() CO(g)+H2O(g))△H=Q3=Q1-Q2>0,说明是吸热反应;
CO(g)+H2O(g))△H=Q3=Q1-Q2>0,说明是吸热反应;
(2)①反应为放热反应,温度越高转化率越小,则T3>T2>T1;
②图2中m1、m2、m3投料比从大到小的顺序为m1>m2>m3,因相同温度下,增大氢气的量,平衡正向移动,二氧化碳的转化率增大;
③温度升高,反应逆向进行,所以产物的物质的量是逐渐减少的,反应物的物质的量增大,由图可知,曲线a代表的物质为H2,b表示CO2,c为H2O,d表示乙醇;设开始氢气的投入量是3nmol,则二氧化碳是nmol,二氧化碳的转化量是x,则
2CO2(g)+6H2(g)![]() C2H5OH(g)+3H2O(g)
C2H5OH(g)+3H2O(g)
起始量(mol) n 3n 0 0
变化量(mol) x 3x 0.5x 1.5x
平衡量(mol) n-x 3n-3x 0.5x 1.5x
P点a、c的体积分数相同,所以3n-3x=1.5x,解得x=![]() n,总物质的量是n-x+3n-3x+0.5x+1.5x=
n,总物质的量是n-x+3n-3x+0.5x+1.5x=![]() n,总压为5MPa的恒压条件下,p(二氧化碳)=p(乙醇)=
n,总压为5MPa的恒压条件下,p(二氧化碳)=p(乙醇)=![]() ×5MPa=0.125×5MPa,p(氢气)=p(水)=
×5MPa=0.125×5MPa,p(氢气)=p(水)=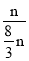 ×5MPa=0.375×5MPa,T4温度时,该反应的平衡常数Kp=
×5MPa=0.375×5MPa,T4温度时,该反应的平衡常数Kp=![]() ;
;
(3)工艺流程是将烟气冷却至15.5~26.5℃后用氨水吸收过量的CO2,该反应是一水合氨和二氧化碳反应生成碳酸氢铵,反应的化学方程式为:NH3H2O+CO2=NH4HCO3,由NH3·H2O的Kb=1.7×10-5,H2CO3的Ka1=4.3×10-7、Ka2=5.6×10-11可知HCO3-的水解程度大于NH4+的水解程度,则所得溶液的pH>7;烟气需冷却至15.5~26.5℃的可能原因是:降低吸收过程中氨气挥发,促进氨水对二氧化碳的成分吸收;
(4)为了测量某湖水中无机碳含量,量取100mL湖水,酸化后用N2吹出CO2,再用NaOH溶液吸收,图象分析可知,生成碳酸氢钠溶液和碳酸钠溶液,二者物质的量之比为1:1,且CO32-的水解程度大于HCO3-,则溶液中离子浓度大小为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】有机物的结构可用“键线式”表示,如CH3—CH=CH—CH3可简写为![]() ,有机物X的键线式为
,有机物X的键线式为![]() 。下列说法中不正确的是( )
。下列说法中不正确的是( )
A.X的分子式为C8H8
B.有机物Y是X的同分异构体,且属于芳香烃,则Y的结构简式为![]()
C.X能使KMnO4酸性溶液褪色
D.X与足量的H2在一定条件下反应可生成环状的饱和烃Z,Z的一氯化物有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图有关图象,说法正确的是( )
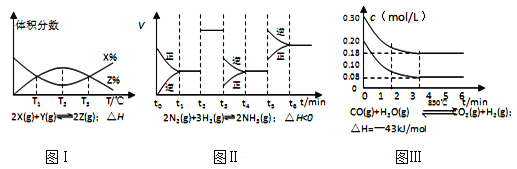
A. 由图Ⅰ知,反应在T1、T3处达到平衡,且该反应的△H<0
B. 由图Ⅱ知,反应在t6时刻,NH3体积分数最大
C. 由图Ⅱ知,t3时采取降低反应体系温度的措施
D. 图Ⅲ表示在10L容器、850℃时的反应,由图知,到4min时,反应放出51.6kJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在一恒容密闭容器中,能表示反应N2(g) +3H2(g)![]() 2NH3(g) 一定达到化学平衡状态的是( )
2NH3(g) 一定达到化学平衡状态的是( )
A. 每1 mol N≡N断裂的同时有6 molN-H生成
B. N2、H2、NH3的浓度之比为1:3:2
C. 气体平均相对分子质量保持不变
D. 气体密度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】结合图回答问题:如图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
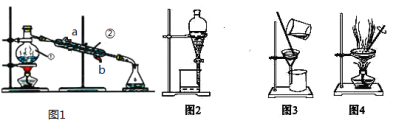
(1)写出上述装置中仪器的名称:①________。
(2)若利用上述装置分离乙酸(沸点118℃)和乙酸乙酯(沸点77.1℃)的混合物,还缺少的仪器有________,图1中仪器 ②是从______口进水(填a或b)。
(3)图2在分液时为使液体顺利滴下,除打开活塞外,还应进行的具体操作是______
(4)从氯化钾溶液中得到氯化钾固体,选择装置______(填代表装置图的序号,下同);除去自来水中的Cl等杂质,选择装置______。
(5)实验室常用上述装置分离碘水中的碘,进行该操作时,需在碘水中加一试剂,在选择试剂时,下列性质你认为哪些性质是必需的:________(填序号)。
①常温下为液态 ②I2在其中溶解程度大 ③与水互不相容 ④密度要比水大。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】核电荷数依次增大的A、B、C、D、E、F都是周期表中前四周期的元素,其中A、B、C是同一周期的非金属元素。化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构,AC2为非极性分子,B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高,E原子的一种核素的质量数为49,中子数为27。F元素是第四周期元素中未成对电子数最多的元素,FCl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2∶1,1mol配合物与足量的AgNO3溶液反应能立即生成3molAgCl。请根据以上情况,回答下列问题:(答题时需用元素符号表示)
(1)B氢化物与HCl反应生成的含有B元素粒子的空间构型是___________;F元素原子的最外层电子数为________个。
(2)B3-离子分别与AC2及由B、C组成的气态化合物互为等电子体,则B、C组成的化合物化学式为_______________;B3-离子还可以和某一价阴离子互为等电子体,该阴离子电子式为_________,这种阴离子常用于检验日常生活中的一种金属阳离子,则金属阳离子符号为_________。
(3)B元素与同周期相邻元素的第一电离能由小到大的顺序为_______________。
(4)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,该反应中氧化剂与还原剂的物质的量之比是_______________。
(5)F3+的核外电子排布式是_________________________,FCl3形成的六配位的配合物化学式为________________________。
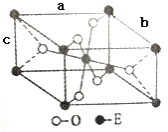
(6)E的一种氧化物晶胞结构(长方体)如图所示,该氧化物的化学式为__________;若该晶胞的三个晶胞参数分别为:apm、bpm、cpm。则该氧化物的密度为____________g/cm3。(写出表达式即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃,四种水溶液① HCl ,② FeCl3 ,③ KOH ,④ Na2CO3 四种水溶液的PH依次为 4、4 、10 、10 ,各溶液中水的电离程度大小关系正确的是 ( )
A.①=②=③=④B.①>③>②>④C.④=②>③=①D.①=③>②=④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验不能达到目的的是
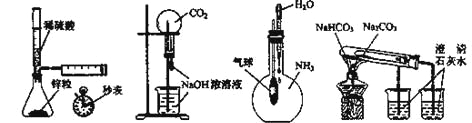
A B C D
A. 测定一定时间内生成H2的反应速率B. 用CO2做喷泉实验
C. 验证NH3易溶于水D. 比较Na2CO3和NaHCO3的热稳定性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①将0.100 L 1.00 mol·L-1的纯碱溶液逐滴滴入0.100 L 1.25 mol·L-1的盐酸中;②将0.100 L 1.25 mol·L-1的盐酸逐滴滴入0.100 L 1.00 mol·L-1的纯碱溶液中;两种操作产生CO2的体积比为
A. 5∶2 B. 2∶5 C. 2∶1 D. 1∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com