
【题目】一定条件下,在一恒容密闭容器中,能表示反应N2(g) +3H2(g)![]() 2NH3(g) 一定达到化学平衡状态的是( )
2NH3(g) 一定达到化学平衡状态的是( )
A. 每1 mol N≡N断裂的同时有6 molN-H生成
B. N2、H2、NH3的浓度之比为1:3:2
C. 气体平均相对分子质量保持不变
D. 气体密度保持不变
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】T ℃时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g) ![]() PCl3(g)+Cl2(g)经过一段时间后达到平衡,反应过程中测定的部分数据如图所示。下列说法正确的是
PCl3(g)+Cl2(g)经过一段时间后达到平衡,反应过程中测定的部分数据如图所示。下列说法正确的是
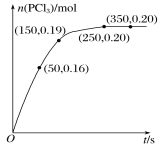
A.反应在前50 s的平均速率v(PCl3)=0.0032 mol·L-1·s-1
B.相同温度下,起始时向容器中充入2.0 mol PCl3和2.0 mol Cl2,达到平衡时,PCl3的转化率小于80%
C.T ℃时,该反应的化学平衡常数K=0.025
D.相同温度下,起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3 和0.20 mol Cl2,反应达到平衡前v正>v逆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中,A是氯气的发生装置,B、C是净化气体的装置,D中装铁丝网;反应后E的底部有棕色固体聚集;F是吸收多余气体的装置。

(1)上述装置中有一处错误,请指出是______处(用字母表示)。
(2)通过F是为了除去_____________。
(3)写出D中发生反应的化学方程式_______。
(4)如果A中产生氯气3.36L(标准状况) [A中的反应为(MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O)]。请计算:。
MnCl2+Cl2↑+2H2O)]。请计算:。
①消耗MnO2的物质的量__________。②被氧化的HCl的物质的量____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,请回答有关问题:

(1)①的元素符号为 _________;
(2)第3周期主族元素中,原子半径最小的是_________(用元素符号表示)。
(3)表中元素的气态氢化物中最稳定的是______________(用化学式表示)。
(4)①、②、⑦、⑧四种元素的最高价氧化物的水化物中酸性最强的是______(用化学式表示)。
(5)①和⑧形成化合物的电子式为_________________
(6)④和⑥两种元素的最高价氧化物的水化物在水溶液中反应的离子方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以某硫酸渣(含Fe2O3、SiO2等)为原料制备铁黄(FeOOH)的一种工艺流程如下:
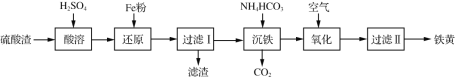
下列说法不正确的是
A. “酸溶”中加热或搅拌或适当增大硫酸浓度均可加快溶解速度
B. 滤渣的主要成分是SiO2和Fe
C. “沉铁”过程中生成Fe(OH)2的化学方程式为: FeSO4+2NH4HCO3===Fe(OH)2↓+ (NH4)2SO4+ 2CO2↑。
D. “氧化”Fe(OH)2浆液时,可用氯气代替空气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,夹子开始处于关闭状态,将液体A滴入试管②与气体B充分反应,打开夹子,可发现试管①内的水立刻沸腾了。液体A和气体B的组合不可能是( )
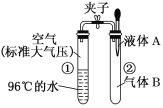
A. 氢氧化钠溶液、一氧化氮
B. 水、氨气
C. 氢氧化钠溶液、二氧化碳
D. 水、二氧化氮
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳及其化合物广泛存在于自然界。请回答下列问题:
(1)反应Ⅰ:Fe(s)+CO2(g) ![]() FeO(s)+CO(g) ΔH1 平衡常数为K1
FeO(s)+CO(g) ΔH1 平衡常数为K1
反应Ⅱ:Fe(s)+H2O(g) ![]() FeO(s)+H2(g) ΔH2 平衡常数为K2
FeO(s)+H2(g) ΔH2 平衡常数为K2
不同温度下,K1、K2的值如下表:
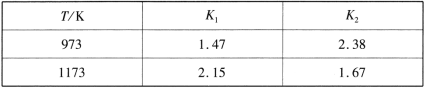
现有反应Ⅲ:H2(g)+CO2(g) ![]() CO(g)+H2O(g),结合上表数据,反应Ⅲ是_______ (填“放热”或“吸热”)反应。
CO(g)+H2O(g),结合上表数据,反应Ⅲ是_______ (填“放热”或“吸热”)反应。
(2)已知CO2催化加氢合成乙醇的反应原理为:
2CO2(g)+6H2(g) ![]() C2H5OH(g)+3H2O(g) H<0。
C2H5OH(g)+3H2O(g) H<0。
设m为起始时的投料比,即m= n(H2)/ n(CO2)。
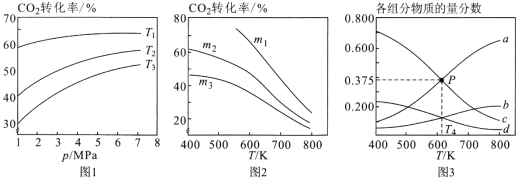
①图1中投料比相同,温度从高到低的顺序为______________________。
②图2中m1、m2、m3从大到小的顺序为________________________。
③图3表示在总压为5MPa的恒压条件下,且m=3时,平衡状态时各物质的物质的量分数与温度的关系。则曲线d代表的物质化学名称为______________,T4温度时,该反应平衡常数KP的计算式为(不必化简)_______________________。
(3)已知:NH3·H2O的Kb=1.7×10-5,H2CO3的Ka1=4.3×10-7、Ka2=5.6×10-11。工业生产尾气中的CO2捕获技术之一是氨水溶液吸收技术,工艺流程是将烟气冷却至15.5℃~26.5℃后用氨水吸收过量的CO2。所得溶液的pH___________7(填“>”、“=”或“<”)。烟气需冷却至15.5℃~26.5℃的可能原因是____________。
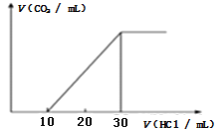
(4)为了测量某湖水中无机碳含量,量取100mL湖水,酸化后用N2吹出CO2,再用NaOH溶液吸收。往吸收液中滴加1.0mol/L盐酸,生成的V(CO2)随V(盐酸)变化关系如图所示,则原吸收液中离子浓度由大到小的顺序为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶解19.2 g(已知硝酸只能被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示。下列分析或结果错误的是( )
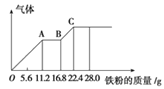
A. 混合酸液中NO3-的物质的量为0.4 mol
B. OA段产生是NO,AB段反应为2Fe3++Fe=3Fe2+,BC段产生氢气
C. 溶液中最终溶质为FeSO4
D. c(H2SO4)为5 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋植物,如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海带中提取碘的流程如下:
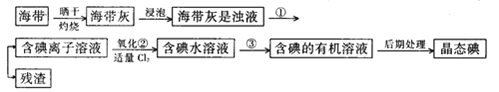
(1)指出提取碘的过程中有关的实验操作名称:①____________________;③______________________。写出实验②中有关反应的离子方程式___________________________________________。
(2)提取碘的过程中,可供选择的有关试剂是___________。
A. 甲苯、酒精 B. 四氯化碳、苯 C. 汽油、乙酸 D. 汽油、甘油
(3)为使海带中I-转化为碘的有机溶液,实验室里有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器。还缺少的仪器是________。
(4)从含碘的有机溶液中提取碘和回收有机溶剂还需经过蒸馏,指出下图实验装置中的错误之处:①_________________②___________________③___________________。
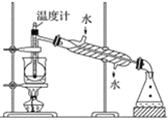
(5)进行上述蒸馏操作时,使用水浴的原因是___________;最后,晶态碘在___________里聚集。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com