
【题目】海洋植物,如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海带中提取碘的流程如下:
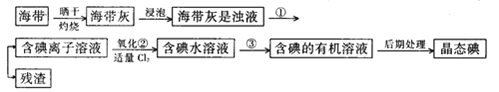
(1)指出提取碘的过程中有关的实验操作名称:①____________________;③______________________。写出实验②中有关反应的离子方程式___________________________________________。
(2)提取碘的过程中,可供选择的有关试剂是___________。
A. 甲苯、酒精 B. 四氯化碳、苯 C. 汽油、乙酸 D. 汽油、甘油
(3)为使海带中I-转化为碘的有机溶液,实验室里有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器。还缺少的仪器是________。
(4)从含碘的有机溶液中提取碘和回收有机溶剂还需经过蒸馏,指出下图实验装置中的错误之处:①_________________②___________________③___________________。
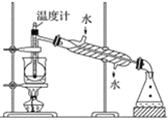
(5)进行上述蒸馏操作时,使用水浴的原因是___________;最后,晶态碘在___________里聚集。
【答案】过滤 萃取分液 2I-+ Cl2 = I2 + 2Cl- B 分液漏斗 缺少石棉网 温度计水银部位应该在支管口处 水流方向应该下进上出 受热均匀,易控制温度 蒸馏烧瓶
【解析】
(1)①是悬浊液分离成溶液和残渣,因此用过滤;③是有机物萃取后分离,因此为萃取分液;实验②中主要是氯气氧化碘离子。
(2)提取碘的过程中,选用不溶于水的有机溶剂。
(3)为使海带中I-转化为碘的有机溶液,因要进行萃取分液,因此还缺少的仪器是分液漏斗。
(4)根据图中信息,错误的有:①缺少石棉网,②温度计水银部位应该在支管口处,③水流方向应该下进上出。
(5)进行上述蒸馏操作时,使用水浴的原因是受热均匀,易控制温度,最后,晶态碘在蒸馏烧瓶里聚集。
(1)①是悬浊液分离成溶液和残渣,因此用过滤;碘的水溶液进行操作③后得到碘的有机溶液,经过了萃取分离,因此为萃取分液;实验②中主要是氯气氧化碘离子,有关反应的离子方程式2I-+ Cl2 = I2 + 2Cl-,故答案为:过滤;萃取分液;2I- + Cl2 = I2 + 2Cl-。
(2)提取碘的过程中,选用不溶于水的有机溶剂,故答案为:B。
(3)为使海带中I-转化为碘的有机溶液,因要进行萃取分液,因此还缺少的仪器是分液漏斗,故答案为:分液漏斗。
(4)根据图中信息,错误的有:①缺少石棉网,②温度计水银部位应该在支管口处,③水流方向应该下进上出,故答案为:缺少石棉网;温度计水银部位应该在支管口处;水流方向应该下进上出。
(5)进行上述蒸馏操作时,使用水浴的原因是受热均匀,易控制温度;最后,有机物的沸点低,先蒸出,晶态碘在蒸馏烧瓶里聚集,故答案为:受热均匀,易控制温度;蒸馏烧瓶。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】一定条件下,在一恒容密闭容器中,能表示反应N2(g) +3H2(g)![]() 2NH3(g) 一定达到化学平衡状态的是( )
2NH3(g) 一定达到化学平衡状态的是( )
A. 每1 mol N≡N断裂的同时有6 molN-H生成
B. N2、H2、NH3的浓度之比为1:3:2
C. 气体平均相对分子质量保持不变
D. 气体密度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验不能达到目的的是
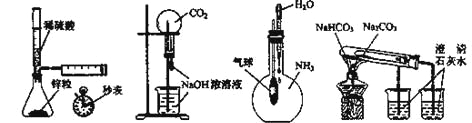
A B C D
A. 测定一定时间内生成H2的反应速率B. 用CO2做喷泉实验
C. 验证NH3易溶于水D. 比较Na2CO3和NaHCO3的热稳定性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组设计了下列装置,验证二氧化碳跟过氧化钠反应时需要与水接触。
(装置分析)
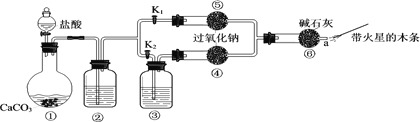
(1)装置①中反应的离子方程式是______。
(2)装置②中的试剂是______(填序号)。
a.饱和Na2CO3溶液 b.饱和NaHCO3溶液 c.浓H2SO4
(3)装置③中的试剂是______。
(进行实验)步骤1:打开弹簧夹K2,关闭K1,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处。 步骤2:打开弹簧夹K1,关闭K2,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处。
(4)步骤1和步骤2中,a处带火星的木条产生的实验现象分别是______。
(5)过氧化钠跟二氧化碳反应的化学方程式是______。
(实验反思)
(6)有同学提出质疑:“上述实验不足以证明有水存在时过氧化钠跟二氧化碳发生了化学反应。”其理由是______。
(7)需要补充的实验操作是:取⑤中反应后的少量固体,______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:
2Fe(s)+O2(g) =2FeO(s) △H=-544kJ·mol-1
4Al(s)+3O2(g) =2Al2O3(s) △H=-3350kJ·mol-1
则2Al(s) +3FeO(s) =Al2O3(s) + 3Fe(s)的△H是
A. - 859 kJ·mol-1 B. +859 kJ·mol-1
C. -1403 kJ·mol-1D. -2491 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时:①HF(aq)+OH-(aq)![]() F-(aq)+H2O(l) ΔH=-67.7 kJ/mol
F-(aq)+H2O(l) ΔH=-67.7 kJ/mol
②H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ/mol下列有关说法中正确的是( )
A.HF电离:HF(aq)![]() H+(aq)+F-(aq)△H=+10.4KJ/mol
H+(aq)+F-(aq)△H=+10.4KJ/mol
B.水解消耗0.1 mol F-时,吸收的热量为6.77 kJ
C.中和热均为57.3 kJ/mol
D.含1 mol HF、1 mol NaOH的两种溶液混合后放出的热量为67.7 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①将0.100 L 1.00 mol·L-1的纯碱溶液逐滴滴入0.100 L 1.25 mol·L-1的盐酸中;②将0.100 L 1.25 mol·L-1的盐酸逐滴滴入0.100 L 1.00 mol·L-1的纯碱溶液中;两种操作产生CO2的体积比为
A. 5∶2 B. 2∶5 C. 2∶1 D. 1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下有:①6.72LCH4,②3.01×1023个HCl分子,③13.6gH2S,④0.2molNH3。下列对这四种气体的描述不正确的是( )
A.体积②>③>①>④B.密度②>③>④>①
C.质量②>③>④>①D.氢原子个数①>③>④>②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2O和Na2O2组成的固体混合物溶于一定量的水中,充分反应后,收到标准状况下的气体1.12L,同时得到0.6molNaOH,求:
(1)原固体混合物中Na2O和Na2O2各是多少克?___、___
(2)所得溶液中应加入1mol/L的硫酸溶液多少毫升才能完全中和?___
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com