
【题目】以某硫酸渣(含Fe2O3、SiO2等)为原料制备铁黄(FeOOH)的一种工艺流程如下:
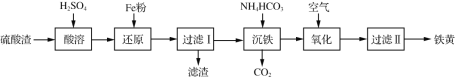
下列说法不正确的是
A. “酸溶”中加热或搅拌或适当增大硫酸浓度均可加快溶解速度
B. 滤渣的主要成分是SiO2和Fe
C. “沉铁”过程中生成Fe(OH)2的化学方程式为: FeSO4+2NH4HCO3===Fe(OH)2↓+ (NH4)2SO4+ 2CO2↑。
D. “氧化”Fe(OH)2浆液时,可用氯气代替空气
【答案】D
【解析】
硫酸渣用硫酸酸浸时,氧化铁溶解生成硫酸铁,加入铁粉,则溶液变为硫酸亚铁溶液,过滤,滤渣为过量的铁粉和未溶解的二氧化硅,滤液中加入碳酸氢铵,发生双水解反应生成二氧化碳和氢氧化亚铁;
A. “酸溶”中加热或搅拌或适当增大硫酸浓度均可加快溶解速度,A正确;
B. 根据分析可知,滤渣的主要成分是SiO2和Fe,B正确;
C. “沉铁”过程中硫酸亚铁与碳酸氢铵双水解生成Fe(OH)2的化学方程式为:FeSO4+2NH4HCO3=Fe(OH)2↓+ (NH4)2SO4+ 2CO2↑,C正确;
D. “氧化”Fe(OH)2浆液时,若用氯气代替空气,导致制备的铁黄含量偏低且含有杂质,D错误;
答案为D


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】(1)6.4gM和17.0gN恰好完全反应,生成0.4molX和12.2gY,则X的摩尔质量为:___。
(2)实验室需要制备22.4L(标准状况)H2,现用质量分数为90.0%的锌粒与足量的稀盐酸反应(假设杂质不与稀盐酸反应),问:(要求写出计算过程)
①至少需要质量分数为90.0%的锌粒多少克?___
②生成的氯化锌的物质的量是多少?___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
回答下列问题:
(1)Z元素在周期表中的位置为___。
(2)下列事实能说明Y元素的非金属性比S元素的非金属性强的是___;
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1molS得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(3)X与Z两元素的单质反应生成1molX的最高价化合物,恢复至室温,放热687kJ,已知该化合物的熔、沸点分别为-69℃和58℃,写出该反应的热化学方程式___。
(4)碳与镁形成的1mol化合物Q与水反应,生成2molMg(OH)2和1mol烃,该烃分子中碳氢质量比为9:1,烃的电子式为___。Q与水反应的化学方程式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图有关图象,说法正确的是( )
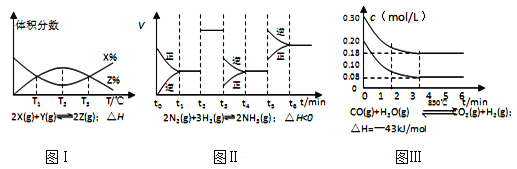
A. 由图Ⅰ知,反应在T1、T3处达到平衡,且该反应的△H<0
B. 由图Ⅱ知,反应在t6时刻,NH3体积分数最大
C. 由图Ⅱ知,t3时采取降低反应体系温度的措施
D. 图Ⅲ表示在10L容器、850℃时的反应,由图知,到4min时,反应放出51.6kJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】800℃时,在2L的密闭容器中发生反应:2NO(g)+O2(g)![]() 2NO2,n(NO)随时间的变化如下表所示。
2NO2,n(NO)随时间的变化如下表所示。
时间∕s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)∕mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)从0~3s内,用NO表示的平均反应速率υ(NO)=_____________。
(2)图中表示NO浓度变化的曲线是_______(填字母代号)。
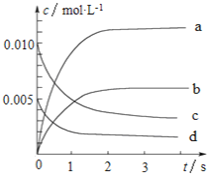
(3)达平衡时NO的转化率为________。
(4)能说明该反应已达到平衡状态的是_________(填序号)。
A.混合气体的颜色保持不变
B.混合气体的密度保持不变
C.υ逆 (NO2)=2υ正 (O2)
D.混合气体的平均相对分子质量保持不变
(5)若升温到850℃,达平衡后n(NO)=n(NO2),则反应向________(填“正反应方向”、“逆反应方向”)移动。
(6)若在一定条件下0.2molNO气体与氧气反应,达平衡时测得放出的热量为akJ,此时NO转化率为80%,则2molNO气体完全反应放出的热量为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在一恒容密闭容器中,能表示反应N2(g) +3H2(g)![]() 2NH3(g) 一定达到化学平衡状态的是( )
2NH3(g) 一定达到化学平衡状态的是( )
A. 每1 mol N≡N断裂的同时有6 molN-H生成
B. N2、H2、NH3的浓度之比为1:3:2
C. 气体平均相对分子质量保持不变
D. 气体密度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】结合图回答问题:如图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
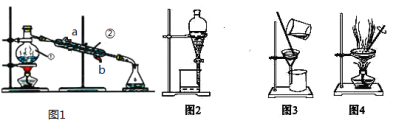
(1)写出上述装置中仪器的名称:①________。
(2)若利用上述装置分离乙酸(沸点118℃)和乙酸乙酯(沸点77.1℃)的混合物,还缺少的仪器有________,图1中仪器 ②是从______口进水(填a或b)。
(3)图2在分液时为使液体顺利滴下,除打开活塞外,还应进行的具体操作是______
(4)从氯化钾溶液中得到氯化钾固体,选择装置______(填代表装置图的序号,下同);除去自来水中的Cl等杂质,选择装置______。
(5)实验室常用上述装置分离碘水中的碘,进行该操作时,需在碘水中加一试剂,在选择试剂时,下列性质你认为哪些性质是必需的:________(填序号)。
①常温下为液态 ②I2在其中溶解程度大 ③与水互不相容 ④密度要比水大。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃,四种水溶液① HCl ,② FeCl3 ,③ KOH ,④ Na2CO3 四种水溶液的PH依次为 4、4 、10 、10 ,各溶液中水的电离程度大小关系正确的是 ( )
A.①=②=③=④B.①>③>②>④C.④=②>③=①D.①=③>②=④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:
2Fe(s)+O2(g) =2FeO(s) △H=-544kJ·mol-1
4Al(s)+3O2(g) =2Al2O3(s) △H=-3350kJ·mol-1
则2Al(s) +3FeO(s) =Al2O3(s) + 3Fe(s)的△H是
A. - 859 kJ·mol-1 B. +859 kJ·mol-1
C. -1403 kJ·mol-1D. -2491 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com