
【题目】氨和硝酸都是重要的工业原料。
(1)标准状况下,将500L氨气溶于水形成1L氨水,则此氨水的物质的量浓度为____mol·L-1(保留三位有效数字)。工业上常用过量氨水吸收二氧化硫,该反应的化学方程式为____。
(2)氨氧化法是工业生产中合成硝酸的主要途径。合成的第一步是将氨和空气的混合气通过灼热的铂铑合金网,在合金网的催化下,氨被氧化成一氧化氮,该反应的化学方程式为____。
下列反应中的氨与氨氧化法中的氨作用相同的是____。
A.2Na+2NH3=2NaNH2+H2↑ B.2NH3+3CuO=3Cu+N2+3H2O
C.4NH3+6NO=5N2+6H2O D.HNO3+NH3=NH4NO3
工业中的尾气(假设只有NO和NO2)用烧碱进行吸收,反应的离子方程式为2NO2+2OH-=NO2-+NO3-+H2O和NO+NO2+2OH-=____+H2O(配平该方程式)。
(3)向27.2gCu和Cu2O的混合物中加入某浓度的稀HNO3500mL,反应过程中产生的气体只有NO。固体完全溶解后,在所得溶液(金属阳离子只有Cu2+)中加入1L1mol·L-1的NaOH溶液使金属离子恰好完全沉淀,此时溶液呈中性,所得沉淀质量为39.2g。
①Cu与稀HNO3反应的离子方程式为____。
②Cu与Cu2O的物质的量之比为____。
③HNO3的物质的量浓度为____mol·L-1。
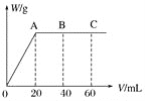
(4)有H2SO4和HNO3的混合溶液20mL,加入0.25molL-1Ba(OH)2溶液时,生成沉淀的质量w(g)和Ba(OH)2溶液的体积V(mL)的关系如图所示(C点混合液呈中性)。则原混合液中H2SO4的物质的量浓度为____mol·L-1,HNO3的物质的量浓度为____mol·L-1。
【答案】22.3 SO2+2NH3H2O=(NH4)2SO3+H2O[或SO2+2NH3+H2O=(NH4)2SO3] 4NH3+5O2![]() 4NO+6H2O BC 2NO2- 3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O 2:1 2.4 0.25 1
4NO+6H2O BC 2NO2- 3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O 2:1 2.4 0.25 1
【解析】
(1)根据c=![]() 计算氨水的浓度;
计算氨水的浓度;
(2)根据已知信息反:应物和生成物书写反应方程式,根据电子守恒配平反应方程式;根据化合价变化判断NH3为还原剂,进行分析其他几反应中氨气的作用;
(3)根据质量守恒,原子守恒、电子守恒规律进行解答;
(4)根据n(H+)=n(OH-)进行分析解答。
(1)标准状况下,将500L氨气溶于水形成1L氨水,则此氨水的物质的量浓度为C=![]() =
= =22.3 mol·L-1。工业上常用过量氨水吸收二氧化硫,二氧化硫与氨气反应生成亚硫酸铵和水,该反应的化学方程式为SO2+2NH3H2O=(NH4)2SO3+H2O[或SO2+2NH3+H2O=(NH4)2SO3],所以答案为:22.3;SO2+2NH3H2O=(NH4)2SO3+H2O[或SO2+2NH3+H2O=(NH4)2SO3];
=22.3 mol·L-1。工业上常用过量氨水吸收二氧化硫,二氧化硫与氨气反应生成亚硫酸铵和水,该反应的化学方程式为SO2+2NH3H2O=(NH4)2SO3+H2O[或SO2+2NH3+H2O=(NH4)2SO3],所以答案为:22.3;SO2+2NH3H2O=(NH4)2SO3+H2O[或SO2+2NH3+H2O=(NH4)2SO3];
(2)将氨和空气的混合气通过灼热的铂铑合金网,在合金网的催化下,氨被氧化成一氧化氮,该反应的化学方程式为4NH3+5O2![]() 4NO+6H2O,所以答案:4NH3+5O2
4NO+6H2O,所以答案:4NH3+5O2![]() 4NO+6H2O;
4NO+6H2O;
A.在4NH3+5O2![]() 4NO+6H2O反应中,氨气做还原剂,2Na+2NH3=2NaNH2+H2↑反应中,氨气做氧化剂,所以与氨氧化法中的氨作用不相同,故A错误;
4NO+6H2O反应中,氨气做还原剂,2Na+2NH3=2NaNH2+H2↑反应中,氨气做氧化剂,所以与氨氧化法中的氨作用不相同,故A错误;
B.在2NH3+3CuO=3Cu+N2+3H2O反应中,氨气做还原剂,所以与氨氧化法中的氨作用相同,故B正确;
C.在4NH3+6NO=5N2+6H2O反应中,氨气做还原剂,所以与氨氧化法中的氨作用相同,故C正确;
D.HNO3+NH3=NH4NO3反应是非氧化还原反应,故D错误;
所以答案:BC。
由质量守恒和得失电子守恒配平,NO中N为+2价,NO2中N为+4,显然是个归中反应,生成化合物中N为+3价,再根据原子守恒,电荷守恒,可知该反应的离子方程式: NO+NO2+2OH-=2NO2-+H2O,故答案为NO2-;
本题答案为:4NH3+5O2![]() 4NO+6H2O;BC;2NO2-;
4NO+6H2O;BC;2NO2-;
(3)向27.2gCu和Cu2O的混合物中加入某浓度的稀HNO3500mL,反应过程中产生的气体只有NO。固体完全溶解后,在所得溶液(金属阳离子只有Cu2+)中加入1L1mol·L-1的NaOH溶液使金属离子恰好完全沉淀,此时溶液呈中性,所得沉淀质量为39.2g。
①Cu与稀HNO3反应生成硝酸铜、一氧化氮和水,其离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,所以答案:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
②所得溶液中加入1mol/L的NaOH溶液1.0L,此时溶液呈中性,金属离子已完全沉淀,溶液中溶质为NaNO3,n(NaNO3)=n(NaOH)=1.0mol/L![]() 1.0L=1mol。沉淀为Cu(OH)2,质量为39.2g,物质的量=
1.0L=1mol。沉淀为Cu(OH)2,质量为39.2g,物质的量=![]() =0.4mol,根据铜元素守恒有n(Cu)+2n(Cu2O)=n[Cu(OH)2],反应后的溶液中n[Cu(NO3)2]=n[Cu(OH)2]=0.4mol。设Cu、Cu2O的物质的量分别为x、y,64x+144y=27.2, x+2y=0.4,解得x=0.2,y=0.1,所以Cu与Cu2O的物质的量之比为2:1;所以答案为2:1;
=0.4mol,根据铜元素守恒有n(Cu)+2n(Cu2O)=n[Cu(OH)2],反应后的溶液中n[Cu(NO3)2]=n[Cu(OH)2]=0.4mol。设Cu、Cu2O的物质的量分别为x、y,64x+144y=27.2, x+2y=0.4,解得x=0.2,y=0.1,所以Cu与Cu2O的物质的量之比为2:1;所以答案为2:1;
③Cu和Cu2O与稀硝酸反应生成硝酸铜,0.2molCu完全反应失去0.4mol电子0.1molCu2O完全反应失去0.2mol电子,总共生成0.6mol电子,由电子守恒,生成NO的物质的量=![]() =0.2mol,所得溶液中加入1L1mol·L-1的NaOH溶液,此时溶液呈中性,金属离子恰好完全沉淀,反应后的溶质为硝酸钠,则溶液中的硝酸根离子的物质的量为
=0.2mol,所得溶液中加入1L1mol·L-1的NaOH溶液,此时溶液呈中性,金属离子恰好完全沉淀,反应后的溶质为硝酸钠,则溶液中的硝酸根离子的物质的量为
n(NO3-)=n(NaOH)=1mol/L![]() 1L=1mol,则硝酸的总物质的量为1mol+0.2mol=1.2mol,硝酸的浓度c=
1L=1mol,则硝酸的总物质的量为1mol+0.2mol=1.2mol,硝酸的浓度c=![]() =2.4mol/L。所以答案为:2.4 mol·L-1。
=2.4mol/L。所以答案为:2.4 mol·L-1。
(4)由图可知,0~20mLBa(OH)2溶液发生H2SO4+Ba(OH)2=BaSO4↓+H2O,20mL~60mLBa(OH)2溶液发生H++OH-=H2O,由图可知,加入20mLBa(OH)2溶液时,硫酸钡沉淀达最大值,设硫酸的物质的量为x,则
H2SO4+Ba(OH)2=BaSO4↓+ H2O
1 1
x 0.02L![]() 0.25mol
0.25mol![]() L-1,解得x=0.02L
L-1,解得x=0.02L![]() 0.25mol
0.25mol![]() L-1=0.005mol,硫酸的物质的量浓度=
L-1=0.005mol,硫酸的物质的量浓度=![]() =0.25 mol
=0.25 mol![]() L-1,由图可知pH=7时,消耗60mLBa(OH)2溶液,由.H++OH-=H2O可知原溶液中含有的n(H+)=n(OH-)=2
L-1,由图可知pH=7时,消耗60mLBa(OH)2溶液,由.H++OH-=H2O可知原溶液中含有的n(H+)=n(OH-)=2![]() 0.06L
0.06L![]() 0.25 mol
0.25 mol![]() L-1=0.03mol,故
L-1=0.03mol,故
n(HNO3)=0.03mol-0.005mol![]() 2=0.02mol,故原溶液中HNO3的物质的量浓度=
2=0.02mol,故原溶液中HNO3的物质的量浓度=![]() =1 mol
=1 mol![]() L-1,故答案为:0.25;1。
L-1,故答案为:0.25;1。


 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:
【题目】某重要有机合成中间体X的结构如图所示,有关该物质的说法不正确的是
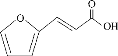
A.X与庚二酸(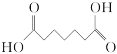 )互为同分异构体
)互为同分异构体
B.X可以使溴水、酸性KMnO4褪色,且原理不相同
C.标准状况下1molX分别和足量Na和NaHCO3反应,生成气体体积不相同
D.X分子中所有碳原子可能共面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ实验室里需要纯净的氯化钠溶液,但实验室只有混有硫酸钠、碳酸氢铵的氯化钠.某学生设计了如下方案进行提纯:

(1)操作②能否改为加硝酸钡溶液,______(填“能”或“否”) ,理由_____________________________。
(2)进行操作②后,如何判断SO42- 已除尽,方法是___________________。
(3)操作④的目的是_______________________________。
Ⅱ硫酸亚铁铵(NH4)2SO4·FeSO4·6H2O为浅绿色晶体,实验室中常以废铁屑为原料来制备,其步骤如下:
步骤1 将废铁屑放入碳酸钠溶液中煮沸除油污,分离出液体,用水洗净铁屑。
步骤2 向处理过的铁屑中加入过量的3mol/L H2SO4溶液,在60℃左右使其反应到不再产生气体,趁热过滤,得FeSO4溶液。
步骤3 向所得FeSO4溶液中加入饱和(NH4)2SO4溶液,经过“一系列操作”后得到硫酸亚铁铵晶体。
请回答下列问题:
(1)在步骤1中,分离操作,所用到的玻璃仪器有___________________________。(填仪器编号)
①漏斗 ②分液漏斗 ③烧杯 ④广口瓶 ⑤铁架台 ⑥玻璃棒 ⑦酒精灯
(2)在步骤3中,“一系列操作”依次为_____________________、_______________________和过滤。
(3)实验室欲用18mol/L H2SO4来配制240mL 3mol/L H2SO4溶液,需要量取________mL浓硫酸,实验时,下列操作会造成所配溶液浓度偏低的是__________________。(填字母)
a.容量瓶内壁附有水珠而未干燥处理 b.未冷却至室温直接转移至容量瓶中
c.加水时超过刻度线后又倒出 d.定容时仰视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验事实不能作为所得结论合理证据的是
选项 | A | B | C | D |
实验 |
|
|
|
|
现象 | NaBr溶液变为橙色,NaI溶液变为棕黄色 | Mg条表面有气泡产生 | Na2SiO3溶液中出现白色沉淀 | 钾与水反应比钠与水反应更剧烈 |
结论 | 氧化性: Cl2>Br2>I2 | 还原性: Mg>Al | 非金属性: C>Si | 金属性: K>Na |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究Na2SO3溶液的性质,在白色点滴板的a、b、c、d四个凹槽中滴入Na2SO3溶液,再分别滴加如图所示的试剂。
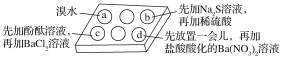
对实验现象的“解释或结论”错误的是( )
实验现象 | 解释或结论 | |
A | a中溴水褪色 | 还原性:SO32->Br- |
B | b中加硫酸后产生淡黄色沉淀 | SO32-和S2-在酸性条件下发生反应 |
C | c中滴入酚酞溶液变红,再加BaCl2溶液后产生白色沉淀且红色褪去 | SO32-+H2O Ba2++SO32-=BaSO3↓,水解平衡向左移动,红色褪去 |
D | d中产生白色沉淀 | Na2SO3溶液已变质 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中装置可以用来发生、洗涤、干燥、收集(不考虑尾气处理)气体。该装置可用于 ( )

A. 锌和盐酸生成氢气
B. 二氧化锰和浓盐酸生成氯气
C. 碳酸钙和盐酸生成二氧化碳
D. 浓氨水和烧碱制取氨气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应![]()
![]()
![]() 的能量变化如图所示,下列叙述正确的是( )
的能量变化如图所示,下列叙述正确的是( )
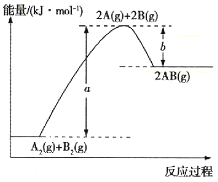
A.该反应属于放热反应
B.1mol A2(g)完全反应吸收(a-b)kJ热量
C.生成1mol AB中的化学键放出![]() kJ热量,断裂1mol A2中的化学键和断裂1mol B2中的化学键均吸收
kJ热量,断裂1mol A2中的化学键和断裂1mol B2中的化学键均吸收![]() kJ热量
kJ热量
D.该反应一定能设计成原电池
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,1mol化学键断裂形成气态原子所需要的能量用![]() 表示。结合表中信息判断下列说法不正确的是( )
表示。结合表中信息判断下列说法不正确的是( )
共价键 | H-H | F-F | H-F | H-Cl | H-I |
E(kJ/mol) | 436 | 157 | 568 | 432 | 298 |
A. 432kJ/mol>E(H-Br)>298kJ/mol B. 表中最稳定的共价键是H-F键
C. H2(g)→2H(g) △H=+436kJ/mol D. H2(g)+F2(g)=2HF(g) △H=-25kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com