
【题目】实验室配制50mL0.2molL-1的Na2SO4溶液,实验操作步骤有:
A.用天平称取14.2g硫酸钠固体,放入小烧杯中,用适量的蒸馏水溶解并冷却至室温;
B.将冷却后的溶液小心转移到容量瓶中;
C.继续向容量瓶中加蒸馏水至液面距刻度线1~2cm处,改用胶头滴管滴加,至溶液凹液面最低点与刻度线相切;
D.用少量蒸馏水洗涤烧杯和玻璃棒2~3次,洗涤液都注入容量瓶中;
E.将容量瓶瓶塞塞紧,振荡,摇匀。
(1)操作步骤的正确顺序为__(填序号)。
(2)本实验用到的基本仪器已有烧杯、天平、玻璃棒,还缺少的仪器是__、__、__。
(3)下列情况中,会使所配制的溶液浓度偏高的是__(填序号)。
a.定容观察液面时如图所示
b.没有进行上述的操作步骤D
c.加蒸馏水时,不慎超过了刻度线
d.砝码上沾有锈渍
e.容量瓶使用前内壁沾有水珠
【答案】ABDCE 药匙 50mL容量瓶 胶头滴管 ad
【解析】
(1)根据配制一定物质的量浓度溶液一般步骤排序;
(2)依据配制一定物质的量浓度溶液一般步骤选择需要的仪器;
(3)分析操作对溶质物质的量和溶液体积的影响,依据c=![]() 进行误差分析。
进行误差分析。
(1)配制一定物质的量浓度溶液一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶贴标签,所以正确的操作步骤为:ABDCE;
(2)配制一定物质的量浓度溶液一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶贴标签,用到的仪器:托盘天平、药匙、玻璃棒、烧杯、50mL容量瓶、胶头滴管,所以缺少的仪器:药匙、50mL容量瓶、胶头滴管;
(3)a.定容观察液面时如图所示,俯视刻度线,导致溶液体积偏小,溶液浓度偏高,故a选;
b.没有进行上述的操作步骤D,导致部分溶质损耗,溶质物质的量偏小,溶液浓度偏低,故b不选;
c.加蒸馏水时,不慎超过了刻度线,导致溶液体积偏大,溶液浓度偏低,故c不选;
d.砝码上沾有锈渍,导致称取溶质的质量偏大,溶质物质的量偏大,溶液浓度偏高,故d选;
e.容量瓶使用前内壁沾有水珠,对溶质物质的量和溶液体积都不产生影响,溶液浓度无影响,故e不选;
故答案为ad。


科目:高中化学 来源: 题型:
【题目】下列反应是氧化还原反应的是( )
A.AgNO3 + HCl ==AgCl↓+ HNO3
B.NH4HCO3 ![]() NH3↑+ CO2↑+ H2O
NH3↑+ CO2↑+ H2O
C.2KClO3 ![]() 2KCl+3O2↑
2KCl+3O2↑
D.CaO+H2O ==Ca(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙(CaO2·8H2O)是一种在水产养殖中广泛使用的供氧剂。
水中溶解氧的测定方法如下:向一定量水样中加入适量MnSO4和碱性KI溶液,生成MnO(OH)2沉淀,密封静置;加入适量稀H2SO4,待MnO(OH)2与I完全反应生成Mn2+和I2后,以淀粉作指示剂,用Na2S2O3标准溶液滴定至终点,测定过程中物质的转化关系如下:
![]()
①写出O2将Mn2+氧化成MnO(OH)2的离子方程式:_____________。
②取加过一定量CaO2·8H2O的池塘水样100.00 mL,按上述方法测定水中溶解氧量,消耗0.01000 mol·L1 Na2S2O3标准溶液13.50 mL。计算该水样中的溶解氧(以mg·L1表示),写出计算过程_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在给定条件下能大量共存的是 ( )
A.在c(HCO![]() )="0.1" mol·L-1的溶液中:NH
)="0.1" mol·L-1的溶液中:NH![]() 、Al3+、Cl-、NO
、Al3+、Cl-、NO![]()
B.有大量![]() 存在的溶液中:Na+、Mg2+、Ca2+、I-
存在的溶液中:Na+、Mg2+、Ca2+、I-
C.有大量![]() 存在的强酸性溶液中:NH
存在的强酸性溶液中:NH![]() 、Ba2+、Fe2+、Br-
、Ba2+、Fe2+、Br-
D.能使红色石蕊试纸变蓝的溶液中:SO![]() 、S2-、Na+、K+
、S2-、Na+、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系符合下图。则甲和X不可能是( )
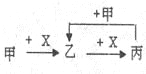
A.甲:C、X:O2
B.甲:NaOH溶液、X:CO2溶液
C.甲:Na、X:O2
D.甲:AlCl3溶液、X:NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2014年3月22日是第二十二届“世界水日”,保护水资,从我做起!
(1)ClO2和Cl2(还原产物都为Cl-)是生活中常用的消毒剂。当消耗等物质的量的两种物质时,ClO2的消毒效率是Cl2的_______倍。
(2)炼金废水中含有络离子[Au(CN)2]+,与弱电解质碳酸的电离方式相似,[Au(CN)2]+也存在着两步电离,其电离出CN-有毒,CN-与H+结合生成毒性更强的HCN。[Au(CN)2]+的一级电离方程式:__________________________;在碱性条件下NaClO将废水中的CN-氧化成CO![]() 和N2,其反应的离子方程式为: _______________________________________________ 。
和N2,其反应的离子方程式为: _______________________________________________ 。
(3)某无色废水中可能含有Fe3+、Al3+、Mg2+、Na+、NO3-、CO32-、SO42-离子中的几种,为分析其成分,分别取废水样品100mL,进行了三组实验,其操作和有关现象如下图所示:

请根据上图回答下列问题:
①实验中需配制1.0mol/L的NaOH溶液100mL,所需仪器除了玻璃棒、托盘天平、量筒、药匙、烧杯、胶头滴管,还缺少的仪器为________________。
②实验③中沉淀量由A→B过程中所发生反应的离子方程式为_______________________________。
③试确定NO3-是否存在?_________________(填“存在”、“不存在”或“不确定”),若存在,试计算c(NO3-)_________________(若不存在,此问不必作答)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用如图装置制得氯气并与铝粉反应制备无水AlCl3。已知AlCl3在183°C升华,遇潮湿空气即反应产生大量白雾。请回答问题:
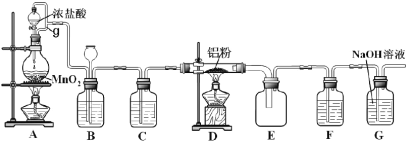
(1)A中反应的化学方程式为_________;HCl在反应中表现出的性质为______(填:酸性、氧化性或还原性)。
(2)A中g管的作用是________。
(3)B中盛放饱和食盐水的作用是________;若D中生成的AlCl3凝华堵塞导管,B中可观察到的现象为________。
(4)C和F所装试剂相同,其中F的作用是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是中学化学中常见的物质,已知C 为红棕色气体,它们之间的相互转化关系如下(部分反应条件及产物已略去)。

(1)若A为单质,则A的化学式为_________,试写出C→D反应的化学方程式:_________。
(2)A亦可为NH3,它与O2 在高温、催化剂的作用下反应生成B,此化学方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一个化学过程的示意图.已知甲池的总反应式为2CH3OH+3O2+4KOH═2K2CO3+6H2O

请回答:
(1)甲池是___,通入O2的电极作为___极,电极反应式为_______.
(2)乙池是_____,A电极名称为__极,电极反应式为_________.
乙池中的总反应离子方程式为_________,一段时间后溶液的pH______(填“增大”、“减小”或“不变”).
(3)当乙池中B(Ag)极的质量增加5.40g时,甲池中理论上消耗O2____mL(标准状况下).当丙为硫酸铜溶液且体积为500 mL,通电后丙溶液的pH=________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com