
【题目】2014年3月22日是第二十二届“世界水日”,保护水资,从我做起!
(1)ClO2和Cl2(还原产物都为Cl-)是生活中常用的消毒剂。当消耗等物质的量的两种物质时,ClO2的消毒效率是Cl2的_______倍。
(2)炼金废水中含有络离子[Au(CN)2]+,与弱电解质碳酸的电离方式相似,[Au(CN)2]+也存在着两步电离,其电离出CN-有毒,CN-与H+结合生成毒性更强的HCN。[Au(CN)2]+的一级电离方程式:__________________________;在碱性条件下NaClO将废水中的CN-氧化成CO![]() 和N2,其反应的离子方程式为: _______________________________________________ 。
和N2,其反应的离子方程式为: _______________________________________________ 。
(3)某无色废水中可能含有Fe3+、Al3+、Mg2+、Na+、NO3-、CO32-、SO42-离子中的几种,为分析其成分,分别取废水样品100mL,进行了三组实验,其操作和有关现象如下图所示:

请根据上图回答下列问题:
①实验中需配制1.0mol/L的NaOH溶液100mL,所需仪器除了玻璃棒、托盘天平、量筒、药匙、烧杯、胶头滴管,还缺少的仪器为________________。
②实验③中沉淀量由A→B过程中所发生反应的离子方程式为_______________________________。
③试确定NO3-是否存在?_________________(填“存在”、“不存在”或“不确定”),若存在,试计算c(NO3-)_________________(若不存在,此问不必作答)。
【答案】2.5 [Au(CN)2]+![]() [Au(CN)]2++CN- 5ClO-+2CN-+2OH-=2CO32-+N2↑+5Cl-+H2O 100mL容量瓶 Al(OH)3+OH-=AlO2-+2H2O 存在 c(NO3-) =0.15 mol/L
[Au(CN)]2++CN- 5ClO-+2CN-+2OH-=2CO32-+N2↑+5Cl-+H2O 100mL容量瓶 Al(OH)3+OH-=AlO2-+2H2O 存在 c(NO3-) =0.15 mol/L
【解析】
(1)设ClO2和Cl2(还原产物都为Cl-都为1mol,则二者得电子的物质的量分别为5mol、2mol,从而可求出ClO2的消毒效率是Cl2的倍数。
(2) [Au(CN)2]+的一级电离产物为[Au(CN)]2+、CN-;在碱性条件下NaClO将废水中的CN-氧化成CO![]() 和N2,则自身被还原为Cl-,由此可写出其反应的离子方程式。
和N2,则自身被还原为Cl-,由此可写出其反应的离子方程式。
(3)①实验中需配制1.0mol/L的NaOH溶液100mL,所需仪器除了玻璃棒、托盘天平、量筒、药匙、烧杯、胶头滴管,还缺少的仪器为100mL容量瓶。
②实验③中沉淀量由A→B过程中所发生反应为Al(OH)3与OH-的反应。
③废水无色,则排除Fe3+,由坐标图象,可确定废水中含有Al3+、Mg2+,则不含有CO32-;由废水中加入BaCl2,生成2.33g白色沉淀,可确定废水中含有SO42-;焰色反应实验,火焰为无色,则废水中不含有Na+。采集数据进行计算,可求出n(SO42-)=![]() ,由反应Al(OH)3+OH-=AlO2-+2H2O,可求出n[Al(OH)3]= n(Al3+)=0.04mol-0.035mol
,由反应Al(OH)3+OH-=AlO2-+2H2O,可求出n[Al(OH)3]= n(Al3+)=0.04mol-0.035mol
=0.005mol;n[Mg(OH)2]= n(Mg2+)=![]() 。利用电荷守恒,可求出n(NO3-),从而确定NO3-是否存在。
。利用电荷守恒,可求出n(NO3-),从而确定NO3-是否存在。
(1)设ClO2和Cl2(还原产物都为Cl-都为1mol,则二者得电子的物质的量分别为5mol、2mol,从而可求出ClO2的消毒效率是Cl2的倍数为![]() =2.5。答案为:2.5;
=2.5。答案为:2.5;
(2) [Au(CN)2]+的一级电离产物为[Au(CN)]2+、CN-,电离方程式为[Au(CN)2]+![]() [Au(CN)]2++CN-;在碱性条件下NaClO将废水中的CN-氧化成CO
[Au(CN)]2++CN-;在碱性条件下NaClO将废水中的CN-氧化成CO![]() 和N2,则自身被还原为Cl-,由此可写出其反应的离子方程式为5ClO-+2CN-+2OH-=2CO32-+N2↑+5Cl-+H2O。答案为:[Au(CN)2]+
和N2,则自身被还原为Cl-,由此可写出其反应的离子方程式为5ClO-+2CN-+2OH-=2CO32-+N2↑+5Cl-+H2O。答案为:[Au(CN)2]+![]() [Au(CN)]2++CN-;5ClO-+2CN-+2OH-=2CO32-+N2↑+5Cl-+H2O;
[Au(CN)]2++CN-;5ClO-+2CN-+2OH-=2CO32-+N2↑+5Cl-+H2O;
(3)①实验中需配制1.0mol/L的NaOH溶液100mL,所需仪器除了玻璃棒、托盘天平、量筒、药匙、烧杯、胶头滴管,还缺少的仪器为100mL容量瓶。答案为:100mL容量瓶;
②实验③中沉淀量由A→B过程中所发生反应为Al(OH)3+OH-=AlO2-+2H2O。答案为:Al(OH)3+
③废水无色,则排除Fe3+,由坐标图象,可确定废水中含有Al3+、Mg2+,则不含有CO32-;由废水中加入BaCl2,生成2.33g白色沉淀,可确定废水中含有SO42-;焰色反应实验,火焰为无色,则废水中不含有Na+。采集数据进行计算,可求出n(SO42-)=![]() ,由反应Al(OH)3+OH-=AlO2-+2H2O,可求出n[Al(OH)3]= n(Al3+)=0.04mol-0.035mol
,由反应Al(OH)3+OH-=AlO2-+2H2O,可求出n[Al(OH)3]= n(Al3+)=0.04mol-0.035mol
=0.005mol;n[Mg(OH)2]= n(Mg2+)=![]() 。利用电荷守恒,可求出n(NO3-)= 2n(Mg2+)+3n(Al3+)-2n(SO42-)=0.015mol,c(NO3-)=
。利用电荷守恒,可求出n(NO3-)= 2n(Mg2+)+3n(Al3+)-2n(SO42-)=0.015mol,c(NO3-)=![]() = 0.15 mol/L,从而确定NO3-存在。答案为:存在;0.15 mol/L。
= 0.15 mol/L,从而确定NO3-存在。答案为:存在;0.15 mol/L。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】回答实验室配制0.1 mol/L的NaOH溶液500 mL实验中的下列问题。
(1)需NaOH_________g。
(2)有以下仪器:
①烧杯 ②100 mL量筒 ③药匙 ④500 mL容量瓶 ⑤胶头滴管 ⑥托盘天平,配制时,还缺少的玻璃仪器是__________________。
(3)下列称量NaOH的操作中,正确的是_______________。(填序号,下同)
①把NaOH直接放在托盘上称量
②把NaOH放在称量纸上称量
③把NaOH放入烧杯中称量
(4)使用容量瓶前必须进行的一步操作是_____________________________。
(5)配制过程中,下列操作会引起误差偏高的是_______________________。
①未洗涤烧杯、玻璃棒
②NaOH溶液未冷却至室温就转移到容量瓶中
③容量瓶不干燥,含有少量蒸馏水
④称量NaOH的时间太长
⑤定容时俯视刻度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型可充电钠离子电池因具有原料储量丰富,价格低廉,安全性高等优点而备受青睐,而![]() 因理论比容量较高,充放电过程中材料结构稳定,有利于
因理论比容量较高,充放电过程中材料结构稳定,有利于![]() 的可逆脱嵌,可以作为一种非常有潜力的正极材料,下列说法不正确的是
的可逆脱嵌,可以作为一种非常有潜力的正极材料,下列说法不正确的是
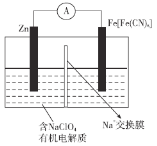
A.放电时,![]() 上的电势比Zn片上的高
上的电势比Zn片上的高
B.放电时,正极反应为![]()
C.充电时,外电路中通过0.2 mol电子时,阴极质量增加6.5 g
D.对于正极材料,充电可实现![]() 的嵌入,放电可实现
的嵌入,放电可实现![]() 的脱嵌
的脱嵌
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废电路板的铜常用FeCl3溶液来溶解处理回收。现将一块电路板浸泡在100 mLFeCl3溶液中使铜全部溶解(电路板上其他物质均不发生反应),测得电路板质量减少了3.2 g,在浸泡液中加足量的Fe粉并使之充分反应,过滤干燥固体,固体质量比加入的Fe粉质量减少了2.4g。
请计算:
(1)浸泡液中的溶质是__________(写化学式) 。
(2)参与反应的铁的质量是__________g。
(3)假设溶液的体积不变,最后所得溶液中c(Fe2+)=__________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室配制50mL0.2molL-1的Na2SO4溶液,实验操作步骤有:
A.用天平称取14.2g硫酸钠固体,放入小烧杯中,用适量的蒸馏水溶解并冷却至室温;
B.将冷却后的溶液小心转移到容量瓶中;
C.继续向容量瓶中加蒸馏水至液面距刻度线1~2cm处,改用胶头滴管滴加,至溶液凹液面最低点与刻度线相切;
D.用少量蒸馏水洗涤烧杯和玻璃棒2~3次,洗涤液都注入容量瓶中;
E.将容量瓶瓶塞塞紧,振荡,摇匀。
(1)操作步骤的正确顺序为__(填序号)。
(2)本实验用到的基本仪器已有烧杯、天平、玻璃棒,还缺少的仪器是__、__、__。
(3)下列情况中,会使所配制的溶液浓度偏高的是__(填序号)。
a.定容观察液面时如图所示
b.没有进行上述的操作步骤D
c.加蒸馏水时,不慎超过了刻度线
d.砝码上沾有锈渍
e.容量瓶使用前内壁沾有水珠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体化合物A,按图所示发生系列变化,已知E溶液中加入氨水后产生的白色沉淀很快变为灰绿色,最后变为红褐色。

回答下列问题:(1)物质A是___(填化学式)。
(2)反应②的离子反应方程式为___。
(3)反应④的化学反应方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了将混有硫酸钠、碳酸氢铵的氯化钠提纯,并制得纯净的氯化钠溶液,某学生设计如下实验:

![]()
![]()
![]()
![]()

![]()
![]()
![]()

![]()
请回答下列问题:
(1)操作②________(填“能”或“不能”)用硝酸钡溶液,说明理由:_______________。
(2)进行操作②后,判断SO![]() 已除尽的方法是____________________。
已除尽的方法是____________________。
(3)操作③的目的是________;不先过滤就滴加碳酸钠溶液,其理由是_________。
(4)此设计方案是否严密?______(填“是”或“否”),说明理由______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为检验浓硫酸与木炭在加热条件下反应产生SO2和CO2气体,设计了下图实验装置,a、b、c为止水夹,B是用于储气的气囊,D中放有用酸性高锰酸钾溶液浸湿的脱脂棉。

请回答下列问题:
(1)实验前需进行的操作是_______________________________
(2)写出圆底烧瓶中所发生的反应方程式____________________________________________
(3)此实验成败的关键在于控制反应产生气体的速率不能过快,由此设计了虚框部分的装置,则正确的操作顺序是________(用编号填写);
①向A装置中加入浓硫酸,加热,使A中产生的气体进入气囊B,当气囊中充入一定量气体时,停止加热;
②待装置A冷却,且气囊B的体积不再变化后,关闭止水夹a,打开止水夹b,慢慢挤压气囊,使气囊B中气体慢慢进入装置C中,待达到实验目的后,关闭止水夹b;
③打开止水夹a和c,关闭止水夹b;
(4)实验时,装置C中的现象为______________
(5)当D中产生______(用字母填写)现象时,可以说明使E中澄清石灰水变浑的是CO2,而不是SO2;
A.进气口一端脱脂棉紫色变浅,出气口一端脱脂棉紫色不变
B.脱脂棉上紫色均变浅 C.脱脂棉上紫色褪去
则装置D的作用为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食品安全关系国计民生,影响食品安全的因素很多.
(1)聚偏二氯乙烯![]()

![]() 具有超强阻隔性能,可作为保鲜食品的包装材料.它是由________
具有超强阻隔性能,可作为保鲜食品的包装材料.它是由________![]() 写结构简式
写结构简式![]() 发生加聚反应生成的,该物质的分子构型是__________________________。
发生加聚反应生成的,该物质的分子构型是__________________________。
(2)劣质植物油中的亚油酸![]() 含量很低,下列关于亚油酸的说法中,正确的是_________。
含量很低,下列关于亚油酸的说法中,正确的是_________。
A.分子式为![]()
B.一定条件下能与甘油![]() 丙三醇
丙三醇![]() 发生酯化反应
发生酯化反应
C.能和NaOH溶液反应
![]() 不能使酸性KMnO4溶液褪色
不能使酸性KMnO4溶液褪色
(3)假酒中甲醇![]() 含量超标,请写出Na和甲醇反应的化学方程式:________。
含量超标,请写出Na和甲醇反应的化学方程式:________。
(4)劣质奶粉中蛋白质含量很低.蛋白质水解的最终产物是________。
(5)在淀粉中加入吊白块制得的粉丝有毒.淀粉最终的水解产物是葡萄糖.请设计实验证明淀粉已经完全水解,写出操作、现象和结论:____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com