
硅藻土是由硅藻死亡后的遗骸沉积形成的,主要成分是 SiO2和有机质,并含有少量的Al2O3、Fe2O3、MgO 等杂质。精制硅藻土因为吸附性强、化学性质稳定等特点被广泛应用。下图是生产精制硅藻土并获得Al(OH)3的工艺流程。
(1)粗硅藻土高温煅烧的目的是 。
(2)反应Ⅲ中生成Al(OH)3沉淀的化学方程式是 ;氢氧化铝常用作阻燃剂,其原因是 。
(3)实验室用酸碱滴定法测定硅藻土中硅含量的步骤如下:
步骤1:准确称取样品a g,加入适量KOH固体,在高温下充分灼烧,冷却,加水溶解。
步骤2:将所得溶液完全转移至塑料烧杯中,加入硝酸至强酸性,得硅酸浊液。
步骤3:向硅酸浊液中加入NH4F溶液、饱和KCl溶液,得K2SiF6沉淀,用塑料漏斗过滤并洗涤。
步骤4:将K2SiF6转移至另一烧杯中,加入一定量蒸馏水,采用70 ℃水浴加热使其充分水解(K2SiF6+3H2O=H2SiO3+4HF+2KF)。
步骤5:向上述水解液中加入数滴酚酞,趁热用浓度为c mol·L-1 NaOH的标准溶液滴定至终点,消耗NaOH标准溶液VmL。
①步骤1中高温灼烧实验所需的仪器除三角架、泥三角、酒精喷灯外还有 。
a.蒸发皿 b.表面皿 c.瓷坩埚 d.铁坩埚
②实验中使用塑料烧杯和塑料漏斗的原因是 。
③步骤3中采用饱和KCl溶液洗涤沉淀,其目的是 。
④步骤4中滴定终点的现象为 。
⑤样品中SiO2的质量分数可用公式“ ×100%”进行计算。由此分析步骤5中滴定反应的离子方程式为 。
×100%”进行计算。由此分析步骤5中滴定反应的离子方程式为 。
(1)除去有机质
(2)①NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3②氢氧化铝分解吸收热量,且生成高熔点的氧化铝覆盖在表面
(3)①d②实验中产生的HF能与玻璃仪器中的SiO2等物质反应③洗去沉淀表面的HF等杂质;增大K+浓度,减少K2SiF6的损失④最后一滴滴入后溶液由无色变为粉红色,且30 s不褪色⑤HF+OH-=F-+H2O
解析试题分析:(1)硅藻土中含有有机质,高温锻烧除去有机质。(2)NaAlO2溶液中通入过量二氧化碳气体生成氢氧化铝和碳酸氢钠;氢氧化铝分解生成氧化铝和水。氧化铝熔点高覆盖在表面且氢氧化铝分解吸热。(3)①灼烧固体应使用坩埚,但瓷坩埚中含有二氧化硅,二氧化硅能与氢氧化钾反应,所以应使用铁坩埚。②玻璃仪器中含有二氧化硅,实验中产生的HF能与二氧化硅反应,所以使用塑料漏斗和塑料烧杯。③用饱和KCl溶液洗涤沉淀,增大K+浓度,减少K2SiF6的损失同时洗去沉淀表面的HF等杂质;④水解液呈酸性,加入酚酞呈无色,当滴加最后一滴溶液时,溶液呈红色且30s不变色,即为终点。⑤若以硅酸与氢氧化钠反应计算,则二氧化硅的质量分数为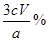 ;若以HF与氢氧化钠反应计算,则二氧化硅的质量分数为
;若以HF与氢氧化钠反应计算,则二氧化硅的质量分数为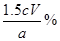 。所以滴定时反应离子方程式为HF+OH-=F-+H2O。
。所以滴定时反应离子方程式为HF+OH-=F-+H2O。
考点: 化学(离子)方程式的书写 化学实验 化学计算


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:单选题
下列装置不能完成实验的是 ( )
| | 装置 | 实验 | | 装置 | 实验 |
| A |  | 结合秒表测 量锌与硫酸 的反应速率 | C |  | 验证化学能 转化为电能 |
| B |  | 吸收多余 HBr气体 | D |  | 实验室制 取少量乙酸 乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业上以锂辉石(Li2O·Al2O3·4SiO2,含少量Ca、Mg元素)为原料生产碳酸锂。其部分工艺流程如下:
已知:①Li2O·Al2O3·4SiO2 H2SO4(浓)
H2SO4(浓) Li2SO4
Li2SO4 Al2O3·4SiO2·H2O↓
Al2O3·4SiO2·H2O↓
②某些物质的溶解度(S)如下表所示:
| T/℃ | 20 | 40 | 60 | 80 |
 (Li2CO3)/g (Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
 (Li2SO4)/g (Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
为了测定含有H2C2O4·2H2O、KHC2O4和K2SO4的试样中各物质的质量分数,进行如下实验:
①称取6.0 g试样,加水溶解,配成250 mL试样溶液。
②用酸式滴定管量取25.00 mL试样溶液放入锥形瓶中,并加入2~3滴酚酞试液,用0.2500 mol/L NaOH溶液滴定,消耗NaOH溶液20.00 mL。
③再取25.00 mL试样溶液放入另一锥形瓶中,用0.1000 mol/L的酸性高锰酸钾溶液滴定,消耗高锰酸钾溶液16.00 mL。
回答下列问题:
(1)已知:0.10 mol/L KHC2O4溶液pH约为3,其中含碳元素的粒子浓度由大到小的顺序为 。
(2)步骤①所需要的玻璃仪器有烧杯、玻璃棒、 。
(3)完成并配平下列离子方程式: C2O42-+ MnO4-+ H+= CO2+ Mn2++
(4)滴定时边滴边摇动锥形瓶,眼睛应观察 。
(5)步骤②中量取试样溶液时,酸式滴定管用蒸馏水洗过后没有润洗,则测得的H2C2O4·2H2O的质量分数 。(填“偏大”、“偏小”或“无影响”)
(6)步骤③中判断滴定终点的方法是 。
(7)试样中H2C2O4·2H2O的质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成分为FeO·Cr2O3,杂质为SiO2、Al2O3)为原料产它,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下图。涉及的主要反应是6FeO·Cr2O3+24NaOH+7KClO3 12Na2CrO4+3Fe2O3+7KCl+12H2O。
12Na2CrO4+3Fe2O3+7KCl+12H2O。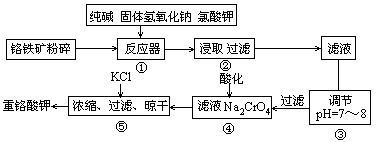
(1)碱浸前将铭铁矿粉碎的作用是
(2)步骤③调节pH后过滤得到的滤渣是 。
(3)操作④中,酸化时,CrO2- 4转化为Cr2O2- 7,写出平衡转化的离子方程式
;
(4)用简要的文字说明操作⑤加入KCl的原因 。
(5)称取重铬酸钾试样2.500g配成250mL溶液,取出25mL与碘量瓶中,加入10mL2mol/ LH2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min。然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol/LNa2S2O3标准溶液滴定(I2+2S2O2- 3=2I- +S4O2- 6)
①判断达到滴定终点的依据是 ;
②若实验中共用去Na2S2O3标准溶液40.00mL,则所得产品中重铬酸钾的纯度为(设整个过程中其它杂质不参加反应) (保留2位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(15分)
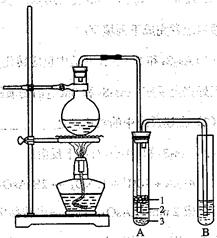
某化学兴趣小组的同学为制取少量溴乙烷,查阅资料得知:
NaBr+H2SO4 HBr+NaHSO4
HBr+NaHSO4
CH3CH2OH+HBr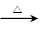 CH3CH2Br+H2O
CH3CH2Br+H2O
化学兴趣小组根据实验原理设计如右图的装置。
根据题意完成下列填空:有关数据列表如下:
| | 乙醇 | 溴乙烷 |
| 状态 | 无色液体 | 无色液体 |
| 密度/g · cm-3 | 0.8 | 1.4 |
| 沸点/℃ | 78.5 | 119.0 |
| 熔点/℃ | -l30 | 38.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(15分) (1)某兴趣小组欲准确配制一定物质的量浓度的NaOH溶液:快速准确称取8.0 g 纯净的NaOH固体,配制成100 mL溶液,该NaOH溶液的物质的量浓度为 。所需的仪器除托盘天平、钥匙、小烧杯、玻璃棒外还缺少 。
(2)有机物X由C、H、O三种元素组成的,为确定其结构进行如下实验:
a.6.0 g X在一定条件下完全分解,生成3.36 L(标准状况下)一氧化碳和1.8 g水;
b.中和2.4 g 有机物X需消耗上述NaOH溶液20.00 mL;
c.0.1 mol有机物X完全转化为酯,需要乙醇9.2 g,0.1 mol X能与足量钠反应放出3.36 L(标准状况下)氢气。则:
①X的相对分子质量为 。
②X的分子式为 。
③写出X的结构简式: 。
④写X与足量乙醇发生酯化反应的方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某同学用下列装置(固定、加热仪器和橡胶管已经省略)进行有关气体制取及其相关实验的探究,回答下列问题.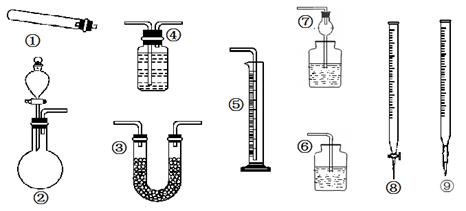
(1)若用装置①制取NH3,其反应的化学方程式为 ;多余的氨气应选用 装置吸收。(填装置序号,下同)
(2)若用装置②制乙炔,其反应的化学方程式为 ;要测定生成乙炔的体积,则必须选择的装置是 ,因制取的乙炔常含有杂质,若要除去杂质,所选装置中应盛放的试剂为: 。
(3)若用装置②制取乙烯,少了一种重要仪器 _。
(4)若用0.01mol/L的酸性高锰酸钾溶液滴定未知浓度的草酸溶液,酸性高锰酸钾溶液应装在装置 中。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。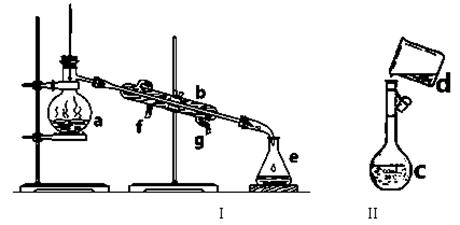
⑴写出下列仪器的名称:a. b. c.
⑵仪器a~c中,使用前必须检查是否漏水的有 。(填序号)
⑶若利用装置I分离四氯化碳和酒精的混合物,还缺少的仪器是 ,
将仪器补充完后进行实验,温度计水银球的位置在 处。
冷凝水由 (填f或g)口通入。
(4)现需配制0.1mol/LNaOH溶液450mL,装置II是某同学转移溶液的示意图。
①图中的错误是 。除了图中给出的的仪器和分析天平外,为完成实验还需要的仪器有: 。
②配制时,其正确的操作顺序是(字母表示,每个字母只能用一次) ________。
| A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶 |
| B.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解 |
| C.将溶解的氢氧化钠溶液沿玻璃棒注入500mL的容量瓶中 |
| D.将容量瓶盖紧,振荡,摇匀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com