
【题目】砷(As)是第四周期ⅤA族元素,可以形成As2S3、As2O5、H3AsO3、H3AsO4等化合物,有着广泛的用途。回答下列问题:
(1)画出砷的原子结构示意图____________;
(2)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式________;
(3)已知:As(s)+ ![]() H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+ ![]() O2(g)=H2O(l) ΔH2
O2(g)=H2O(l) ΔH2
2As(s)+ ![]() O2(g) =As2O5(s) ΔH3
O2(g) =As2O5(s) ΔH3
则反应As2O5(s) +3H2O(l)= 2H3AsO4(s)的ΔH =_________;
(4)298 K时,将20 mL 3x mol·L1 Na3AsO3、20 mL 3x mol·L1 I2和20 mL NaOH溶液混合,发生反应: ![]() (aq)+I2(aq)+2OH(aq)
(aq)+I2(aq)+2OH(aq)![]()
![]() (aq)+2I(aq)+ H2O(l)。溶液中c(
(aq)+2I(aq)+ H2O(l)。溶液中c(![]() )与反应时间(t)的关系如图所示。
)与反应时间(t)的关系如图所示。

①下列不可判断反应达到平衡的是__________(填标号);
a.溶液的pH不再变化 b.v(I)=2v(![]() )
)
c.c(![]() )/c(
)/c(![]() )不再变化 d.c(I)=y mol·L1
)不再变化 d.c(I)=y mol·L1
②tm时,v逆_____ v正(填“大于”“小于”或“等于”);
③tn时v逆_____ tm时v逆(填“大于”“小于”或“等于”);
④若平衡时溶液的pH=14,则该反应的平衡常数K为___________;
(5)H3AsO3和H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如题图-1和题图-2所示:
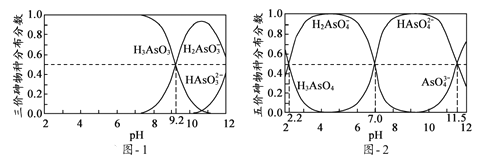
①以酚酞为指示剂(变色范围pH 8.0 ~ 10.0),将NaOH溶液逐滴加入到H3AsO3溶液中,当溶液由无色变为浅红色时停止滴加。该过程中主要反应的离子方程式为____________;
②H3AsO4第一步电离方程式H3AsO4![]() H2AsO4-+H+的电离常数为Ka1,则pKa1=_________(p Ka1 = -lg Ka1);
H2AsO4-+H+的电离常数为Ka1,则pKa1=_________(p Ka1 = -lg Ka1);
(6)溶液的pH对吸附剂X表面所带电荷有影响,pH =7.1时,吸附剂X表面不带电荷;pH > 7.1时带负电荷,pH越高,表面所带负电荷越多;pH<7.1时带正电荷,pH越低,表面所带正电荷越多。pH不同时吸附剂X对三价砷和五价砷的平衡吸附量(吸附达平衡时单位质量吸附剂X吸附砷的质量)如题图-3所示:
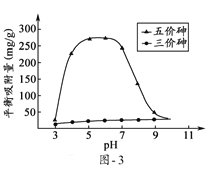
试问,提高吸附剂X对三价砷去除效果可采取的措施是______________________。
【答案】 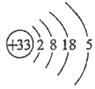 2As2S3+5O2+6H2O=4H3AsO4+6S 2△H1-3△H2-△H3 bd 小于 大于
2As2S3+5O2+6H2O=4H3AsO4+6S 2△H1-3△H2-△H3 bd 小于 大于 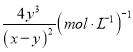 OH- + H3AsO3
OH- + H3AsO3![]() H2AsO3- + H2O 2.2 加入氧化剂,将三价砷转化为五价砷
H2AsO3- + H2O 2.2 加入氧化剂,将三价砷转化为五价砷
【解析】 (1).砷为33号元素,原子结构示意图为![]() ;(2)原已知可知得到As2S3+O2→H3AsO4+S,As2S3化合价总共升高10价,利用得失电子守恒配平得:2As2S3+5O2→4H3AsO4+6S,再考虑质量守恒,反应前少了6O、12H,故方程式为2As2S3+5O2+6H2O=4H3AsO4+6S;(3)待求解反应可以由反应①×1-反应②×3-反应③,故ΔH = 2△H1-3△H2-△H3;(4)①溶液pH不变时,则c(OH—)也保持不变,a能判断反应处于平衡状态;根据速率关系v (I—)=2v(AsO33—),则等式始终成立,b不能判断反应处于平衡状态;由于提供的Na3AsO3总量一定,所以c(AsO43—)/c(AsO33—)不再变化,能判断反应处于平衡状态;c(I-)=y mol/L时,即c(AsO43)=c(I-),事实两者浓度关系一定是2c(AsO43)=c(I-),不能判断反应平衡状态;②反应从正反应开始进行,tm时反应继续向正反应方向进行,故v逆小于 v正;③tm时比tn时,AsO43—浓度更小,所以逆反应速率也更小,tn时v逆大于 tm时v逆;④反应前,三种溶液混合后,Na3AsO3浓度为
;(2)原已知可知得到As2S3+O2→H3AsO4+S,As2S3化合价总共升高10价,利用得失电子守恒配平得:2As2S3+5O2→4H3AsO4+6S,再考虑质量守恒,反应前少了6O、12H,故方程式为2As2S3+5O2+6H2O=4H3AsO4+6S;(3)待求解反应可以由反应①×1-反应②×3-反应③,故ΔH = 2△H1-3△H2-△H3;(4)①溶液pH不变时,则c(OH—)也保持不变,a能判断反应处于平衡状态;根据速率关系v (I—)=2v(AsO33—),则等式始终成立,b不能判断反应处于平衡状态;由于提供的Na3AsO3总量一定,所以c(AsO43—)/c(AsO33—)不再变化,能判断反应处于平衡状态;c(I-)=y mol/L时,即c(AsO43)=c(I-),事实两者浓度关系一定是2c(AsO43)=c(I-),不能判断反应平衡状态;②反应从正反应开始进行,tm时反应继续向正反应方向进行,故v逆小于 v正;③tm时比tn时,AsO43—浓度更小,所以逆反应速率也更小,tn时v逆大于 tm时v逆;④反应前,三种溶液混合后,Na3AsO3浓度为![]() ,同理I2的浓度为xmol/L,反应达到平衡时,生成c(AsO43—)为ymol/L,则反应生成c(I—)为2ymol/L,消耗AsO33—、I2浓度均为ymol/L,平衡时c(AsO33—)为(x-y)mol/L、c(I2) 为(x-y)mol/L,pH=14,即c(OH—)=1mol/L,K=
,同理I2的浓度为xmol/L,反应达到平衡时,生成c(AsO43—)为ymol/L,则反应生成c(I—)为2ymol/L,消耗AsO33—、I2浓度均为ymol/L,平衡时c(AsO33—)为(x-y)mol/L、c(I2) 为(x-y)mol/L,pH=14,即c(OH—)=1mol/L,K=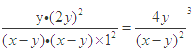 ;(5)①从题图-1可知pH由小变大时,H3AsO3浓度减小, H2AsO3—浓度增大,当溶液由无色变为浅红色时,主要的离子反应为:OH- + H3AsO3
;(5)①从题图-1可知pH由小变大时,H3AsO3浓度减小, H2AsO3—浓度增大,当溶液由无色变为浅红色时,主要的离子反应为:OH- + H3AsO3![]() H2AsO3- + H2O;②H3AsO4的第一步电离:H3AsO4
H2AsO3- + H2O;②H3AsO4的第一步电离:H3AsO4![]() H2AsO4-+H+的电离常数Ka1=
H2AsO4-+H+的电离常数Ka1=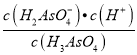 ,由题图-2读出,c(H3AsO4)= c(H2AsO4-),c(H+)=10-2.2mol/L,pKa1= -lg Ka1=-lg10-2.2
,由题图-2读出,c(H3AsO4)= c(H2AsO4-),c(H+)=10-2.2mol/L,pKa1= -lg Ka1=-lg10-2.2


科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.其他条件不变时增大压强,能使全气体反应体系中活化分子百分数增加
B.中和反应都是放热反应
C.在FeCl3溶液和KSCN溶液反应的平衡体系中,加入KCl固体,平衡逆向移动
D.熵增大的反应不一定自发,但自发反应熵一定增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳是一种常见的元素,它以多种形式广泛存在于自然界之中。
(1)星际空间存在多种有机分子和无机分子,多数都含有碳元素,C2是一种星际分子,C2和C60互为_______________。
(2)CO2是碳元素重要的氧化物,回答下列有关问题:
①利用CO2与Na2O2反应,可向呼吸面具中提供氧气,其反应方程式为_________________。
②工业上可由CO2和NH3在一定条件下合成尿素,反应方程式为2NH3+CO2![]() CO(NH2)2+H2O当
CO(NH2)2+H2O当![]() 时,CO2的转化率随时间的变化关系如图所示.
时,CO2的转化率随时间的变化关系如图所示.
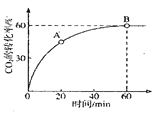
A点的逆反应速率![]() __________B点的正反应速率
__________B点的正反应速率![]() (填“大于“小于”或“等于”),NH3的平衡转化率为____________。
(填“大于“小于”或“等于”),NH3的平衡转化率为____________。
③随着对环境问题认识的深入,CO2的转化捕获问题已成为科研热点之一,以附着纳米银的惰性电极作阴极,可电解CO2转化为CO,装置示意图如下:
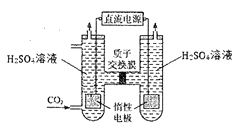
写出通CO2侧电极反应式_________________。
④CO2可用于生产碳酸饮料。苯甲酸钠(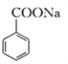 可写为C6H5COONa)也是某些饮料的添加剂,具有抑菌防腐的作用。研究表明苯甲酸(C6H5COOH)的抑菌能力显著高于苯甲酸钠。在生产的某饮料的过程中,除了添加苯甲酸钠外,还需加压充入CO2气体。若忽略碳酸的二级电离,试写出碳酸与苯甲酸钠反应的离子方程式__________________,经计算该反应的化学平衡常数为______________,加压充入CO2后,该饮料的抑菌能力明显增强,结合上述离子方程式分析其原因_______________(已知:H2CO3的Ka1=4.17×10-7;C6H5COOH的Ka=6.25×10-5。)。
可写为C6H5COONa)也是某些饮料的添加剂,具有抑菌防腐的作用。研究表明苯甲酸(C6H5COOH)的抑菌能力显著高于苯甲酸钠。在生产的某饮料的过程中,除了添加苯甲酸钠外,还需加压充入CO2气体。若忽略碳酸的二级电离,试写出碳酸与苯甲酸钠反应的离子方程式__________________,经计算该反应的化学平衡常数为______________,加压充入CO2后,该饮料的抑菌能力明显增强,结合上述离子方程式分析其原因_______________(已知:H2CO3的Ka1=4.17×10-7;C6H5COOH的Ka=6.25×10-5。)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用NaOH溶液滴定H2C2O4 溶液,溶液中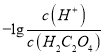 和-lgc(HC2O4-)或
和-lgc(HC2O4-)或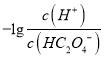 和-lgc(C2O42-)关系如图所示,下列说法正确的是
和-lgc(C2O42-)关系如图所示,下列说法正确的是
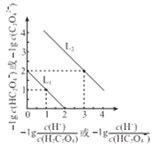
A. 曲线L1表示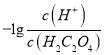 和-lgc(HC2O4-)的关系
和-lgc(HC2O4-)的关系
B. Ka2(H2C2O4)的数量级为10-2
C. NaHC2O4溶液中c(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)
D. 向0.1mol/LH2C2O4溶液中加入少量水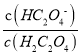 减小
减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬是人体必需元素,如含量不足会影响糖类和脂类的代谢,过高则会引起急性中毒。工业上往往采取下列循环工艺防止铬的污染:

完成下列填空:
(1)含Cr2O72-离子的废水在酸性条件下用Fe3O4处理,反应的离子方程式如下,配平该离子反应方程式:
_____Cr2O72-+Fe3O4+H+→Cr3++Fe3++H2O
(2)工业上处理含Cr2O72-的废水时,一般将剧毒的Cr2O72-转化为Cr3+,以碳为阴极,铁作阳极,电解处理含NaCl、Cr2O72-的酸性废水。写出电极反应:阳极_____________________ 阴极_______________________;用铁做阳极的目的是:_____________________
(3)反应⑤是可逆反应,在Na2CrO4溶液中加入稀硫酸,溶液由黄色逐渐变成橙色,写出该反应的离子方程式:______________________
(4)已知Ag2CrO4和AgCl的Ksp分别为9.0×10-12、1.56×10-10,向含有相同浓度的Na2CrO4和NaCl的混合溶液中逐滴加入硝酸银溶液,首先生成的沉淀是__________
(5)向上述反应后的溶液中加入碱溶液,让废水的pH升至8~10,控制适当的温度,使产物中的金属阳离子全部转变为沉淀。回收所得的Cr(OH)3,经处理后又可转变成K2Cr2O7。纯净的K2Cr2O7常用于准确测定Na2S2O3溶液的物质的量浓度,方法如下:① Cr2O72- +6I- + 14H+ →3I2 + 2Cr3+ + 7H2O ② 2S2O32- + I2→S4O62- + 2I- ,准确称取纯净的K2Cr2O7 0.294g ,配成溶液,用Na2S2O3溶液滴定,消耗Na2S2O3溶液25.00mL。则Na2S2O3溶液的物质的量浓度为_____________________(保留四位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由乙烯推测丙烯的结构或性质,正确的是( )
A. 不能使酸性高锰酸钾溶液褪色,但能使溴水褪色
B. 分子中所有原子都在同一平面上
C. 与HCl加成只生成一种产物
D. 由丙烯之间的相互加成可得聚丙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金刚石和石墨均为碳的同素异形体,氧气不足时它们燃烧生成一氧化碳,充分燃烧时生成二氧化碳,反应中放出的热量如图所示。

(1)写出石墨转化为金刚石的热化学方程式____________________________________。
(2)写出石墨和二氧化碳反应生成一氧化碳的热化学方程式_____________________。
(3)科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如下:
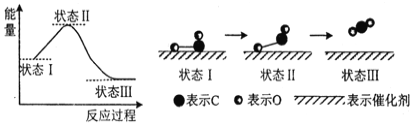
①判断CO和O生成CO2是放热反应的依据是__________________。
②写出CO2的电子式___________________,CO2含有的化学键类型是(若含共价键,请标明极性或非极性)______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1mol Na转变为Na+时失去的电子数为( )
A.3.01×1023
B.6.02×10﹣23
C.1.204×1023
D.6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列化合物的结构分析回答:
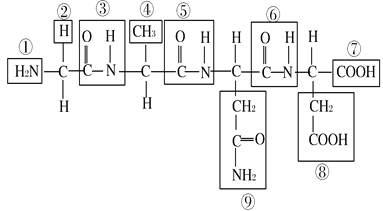
(1) 该化合物中,①表示 ,⑦表示 。
(2) 该化合物由 个氨基酸失去 个水分子而形成,这种反应叫做 。
(3) 该化合物中的氨基酸种类不同,是由 决定的,其编号是 。
(4) 该化合物称为 ,含 个肽键,编号是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com