

 ;
; .
. 分析 由元素在周期表中位置,可知①为C、②为O、③为F、④为Mg、⑤为Al、⑥为Se、⑦为S、⑧为Cl、⑨为H、⑩为N.
(1)同周期自左而右元素非金属性增强,同主族自上而下元素非金属性减弱;
(2)元素②⑧⑨以原子个数比1:1:1形成的化合物为HClO;
元素②与⑨形成的18e-化合物为H2O2,分子中O原子之间形成1对共用电子对,O原子与H原子之间形成1对共用电子对;
(3)②、⑨、⑩三种元素形成的化合物M中原子个数比为3:4:2,电子总数为42,M为NH4NO3;
(4)周期表中,同周期元素的原子从左到右,气态氢化物的稳定性逐渐增强,同主族从下到上,气态氢化物的稳定性逐渐增强;
(5)氧氧化铝是两性氧化物,能和强碱反应;
(6)元素④和③形成的化合物为MgF2,由镁离子与氟离子构成,用Mg原子、F原子电子式表示其形成过程.
解答 解:由元素在周期表中位置,可知①为C、②为O、③为F、④为Mg、⑤为Al、⑥为Se、⑦为S、⑧为Cl、⑨为H、⑩为N.
(1)同周期自左而右元素非金属性增强,同主族自上而下元素非金属性减弱,故上述元素中F元素非金属性最强,为③号F元素,故答案为:③;
(2)元素②⑧⑨以原子个数比1:1:1形成的化合物为HClO,其结构式为H-O-Cl.元素②与⑨形成的18e-化合物为H2O2,分子中O原子之间形成1对共用电子对,O原子与H原子之间形成1对共用电子对,其电子式为: ,
,
故答案为:H-O-Cl; ;
;
(3)②、⑨、⑩三种元素形成的化合物M中原子个数比为3:4:2,电子总数为42,M为NH4NO3,含有离子键和化学键,
故答案为:离子键和化学键;
(4)周期表中,同周期元素的原子从左到右,气态氢化物的稳定性逐渐增强,同主族从下到上,气态氢化物的稳定性逐渐增强,所以稳定性:HCl>H2O>H2Se,
故答案为:HCl;H2O;H2Se;
(5)氧化铝是两性氧化物,能和强碱反应,即Al2O3+2OH-=2AlO2-+H2O,故答案为:Al2O3+2OH-=2AlO2-+H2O;
(6)元素④和③形成的化合物为MgF2,由镁离子与氟离子构成,属于离子化合物,用Mg原子、F原子电子式表示其形成过程为: ,
,
故答案为:离子; .
.
点评 本题考查元素周期表与元素周期律,难度不大,侧重对元素周期律与化学用语的考查,注意掌握用电子式表示物质或化学键的形成.


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:解答题
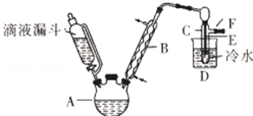 已知:R-OH+HX→R-X+H2O如图是实验室用乙醇与浓硫酸和溴化钠反应制备溴乙烷的装置,图中省去了加热装置.乙醇、溴乙烷、溴有关参数数据见表:
已知:R-OH+HX→R-X+H2O如图是实验室用乙醇与浓硫酸和溴化钠反应制备溴乙烷的装置,图中省去了加热装置.乙醇、溴乙烷、溴有关参数数据见表:| 乙醇 | 溴乙烷 | 溴 | |
| 状态 | 无色液体 | 无色液体 | 深红棕色液体 |
| 密度/g•cm-3 | 0.79 | 1.44 | 3.1 |
| 沸点/℃ | 78.5 | 38.4 | 59 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 金属钛(Ti)被称为21世纪金属,在航海、航空、记忆和涂料方面应用广泛,TiO2是一种优良的光催化剂.20世纪科学家尝试用多种方法将金红石(TiO2)还原,发现金红石直接氯化是冶炼钛的关键步骤:
金属钛(Ti)被称为21世纪金属,在航海、航空、记忆和涂料方面应用广泛,TiO2是一种优良的光催化剂.20世纪科学家尝试用多种方法将金红石(TiO2)还原,发现金红石直接氯化是冶炼钛的关键步骤:| 实验组别 | 1 | 2 | 3 | 4 |
| T/K | 303 | 313 | 323 | 353 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 | 2.0 |
| O2生成量/(10-6mol) | 3.6 | 4.4 | 4.5 | 1.5 |
| 反应时间/h | 3 | 3 | 3 | 3 |
| 容器体积/L | 2 | 2 | 2 | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
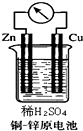 如图所示的铜-锌原电池中,理论上应观察到的现象是:
如图所示的铜-锌原电池中,理论上应观察到的现象是:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | WX2、WZ2分子中所有原子最外层都为8电子结构 | |
| B. | WX2、ZX2的化学键类型和晶体类型都相同 | |
| C. | X的氢化物的熔沸点比Z的氢化物的熔沸点高 | |
| D. | 原子半径大小顺序为X<W<Y<Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
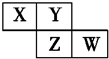 X、Y、Z、W均为短周期元素,它们在周期表中的位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中的位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )| A. | 原子半径:W>Z>Y>X | |
| B. | 最高价氧化物对应水化物的酸性:Z>W>X | |
| C. | 气态氢化物溶液的pH:X>Y>W | |
| D. | Y的氢化物的沸点低于同族元素Z的氢化物的沸点 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .有机物X的键线式为
.有机物X的键线式为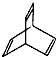
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com