
【题目】关于碱金属元素的下列叙述中,错误的是( )
A.碱金属元素原子最外层都只有1个电子
B.随电子层数增加,原子半径增大,金属还原性增强
C.随核电荷数递增,氢氧化物碱性增强
D.Li、Na、K、Rb、Cs,单质熔沸点升高,密度增大
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:
【题目】对于A2 + 3B2![]() 2C+D的反应来说,以下化学反应速率的表示中,反应速率最快的是( )
2C+D的反应来说,以下化学反应速率的表示中,反应速率最快的是( )
A.v(B2) =0.8mol(Ls)-1 B.v(A2) =0.4 mol(Ls)-1
C.v(C) =0.6 mol(Ls)-1 D.v(D) =0.1 mol(Ls)-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g),K1 △H1<0 (Ⅰ)
NaNO3(s)+ClNO(g),K1 △H1<0 (Ⅰ)
2NO(g)+Cl2(g)![]() 2ClNO(g),K2 △H2<0 (Ⅱ)
2ClNO(g),K2 △H2<0 (Ⅱ)
(1)4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示).
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示).
(2)为研究不同条件对反应(Ⅱ)的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应(Ⅱ)达到平衡,测得10min内v(ClNO)=7.5×10﹣3mol·L﹣1·min﹣1,则平衡后n(Cl2)= mol,NO的转化率α1= .其他条件保持不变,反应(Ⅱ)在恒压条件下进行,平衡时NO的转化率α2 α1(填“>”“<”或“=”),平衡常数K2 (填“增大”“减小”“不变”).若要使K2减小,可采取的措是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时,在20.0mL0.10mol·L-1氯水中滴入0.10mol·L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。己知0.10mol·L-1氨水的电离度为1.32%,下列有关叙述正确的是

A. 该滴定过程应该选择酚酞作为指示剂
B. M点对应的盐酸体积为20.0mL
C. M点处的溶液中c(NH4+)=c(Cl-)=c(H+)=c(OH-)
D. N点处的溶液中pH<12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组欲在实验室探究氯气的性质及模拟工业制取漂白粉,设计了如下装置进行实验。
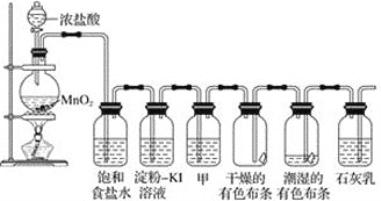
请按要求回答下列问题:
(1)饱和食盐水的作用是_______________________________;
(2)淀粉-KI溶液中观察到的现象是_____________,反应的离子方程式为_______________。
(3)若干燥的有色布条不褪色,湿润的有色布条褪色,由该现象可得出的结论是___________________甲中盛放的试剂是____________。
(4)Cl2与石灰乳反应制取漂白粉的离子方程式为________________________;
(5)该兴趣小组用17.4 g 二氧化锰与足量的浓盐酸制备氯气,反应的离子方程为____________,理论上最多可制得标准状况下氯气的体积是_______L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.IA族和ⅦA族原子化合时,一定生成离子键
B.具有共价键的化合物就是共价化合物
C.由非金属元素形成的化合物一定是共价化合物
D.离子化合物中一定有离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 X、Y、Z、Q、R、E六种前四周期元素中,原子序数X<Y<Z<Q<R<E,其结构或性质信息如下表。
元素 | 结构或性质信息 |
X | 原子的L层上s电子数等于p电子数 |
Y | 原子核外的L层有3个未成对电子 |
Z | 地壳中含量最多的元素 |
Q | 单质常温常压下是气体,原子的M层上有1个未成对的p电子 |
R | 核电荷数是Y与Q的核电荷数之和 |
E | N能层上只有一个电子,K、L、M层均排满电子 |
(1)写出元素Y的原子核外价电子排布图:________________。X的一种氢化物相对分子质量为26,其分子中的σ键与π键的键数之比为__________。
(2)X、Y、Z三种元素的第一电离能由高到低的排列为(写元素符号)__________。三种元素电负性由大到小的顺序为(填元素符号)_____________。
(3)X、Z元素分别与氢元素形成的最简单化合物中,沸点较高的为(写化学式)__________,原因是________________。
(4)XZ与Y2属于等电子体,写出化合物XZ的结构式:________________。
(5)R的一种配合物的化学式为RCl3·6H2O。已知0.01 mol RCl3·6H2O在水溶液中用过量硝酸银溶液处理,产生0.02 mol AgCl沉淀。此配合物最可能是________________。
A.[R(H2O)6]Cl3 B.[R(H2O)5Cl]Cl2·H2O
C.[R(H2O)4Cl2]Cl·2H2O D.[R(H2O)3Cl3]·3H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com