
【题目】下列物质中,属于非电解质的是
A. NaOH B. H2SO4 C. 蔗糖 D. NaCl
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某氧化铝样品中含有氧化铁、氧化亚铁和二氧化硅杂质,现欲制取纯净的氧化铝,某同学设计如下的实验方案,请回答下列问题:
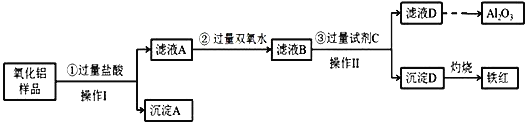
(1)操作I的名称是_________,该操作用到的玻璃棒的作用:_______________。
(2)沉淀A的成分是__________(填化学式);
(3)滤液D焰色反应呈黄色,试剂C是____________(填化学式);步骤③中铝元素转化的离子方程式为 _____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2016·新课标全国卷Ⅰ) 秸秆(含多糖类物质)的综合应用具有重要的意义。下面是以秸秆为原料合成聚酯类高分子化合物的路线:
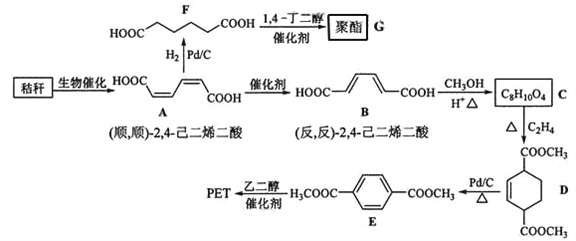
回答下列问题:
(1)下列关于糖类的说法正确的是______________。(填标号)
a.糖类都有甜味,具有CnH2mOm的通式
b.麦芽糖水解生成互为同分异构体的葡萄糖和果糖
c.用银镜反应不能判断淀粉水解是否完全
d.淀粉和纤维素都属于多糖类天然高分子化合物
(2)B生成C的反应类型为______。
(3)D中官能团名称为______,D生成E的反应类型为______。
(4)F 的化学名称是______,由F生成G的化学方程式为______。
(5)具有一种官能团的二取代芳香化合物W是E的同分异构体,0.5 mol W与足量碳酸氢钠溶液反应生成44 g CO2,W共有______种(不含立体结构),其中核磁共振氢谱为三组峰的结构简式为_________。
(6)参照上述合成路线,以(反,反)2,4己二烯和C2H4为原料(无机试剂任选),设计制备对二苯二甲酸的合成路线_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氧化铝样品中含有氧化铁、氧化亚铁和二氧化硅杂质,现欲制取纯净的氧化铝,某同学设计如下的实验方案,请回答下列问题: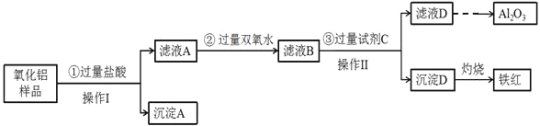
(1)操作I的名称是_________;写出沉淀A和烧碱溶液反应的化学方程式__________。
(2)滤液A中加入过量双氧水的目的是___________;验证滤液A中存在Fe3+的具体操作和现象为:_________________。
(3)滤液D焰色反应呈黄色,试剂C是_________(填化学式);步骤③中铝元素转化的离子方程式为 _____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于碱金属元素的下列叙述中,错误的是( )
A.碱金属元素原子最外层都只有1个电子
B.随电子层数增加,原子半径增大,金属还原性增强
C.随核电荷数递增,氢氧化物碱性增强
D.Li、Na、K、Rb、Cs,单质熔沸点升高,密度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:
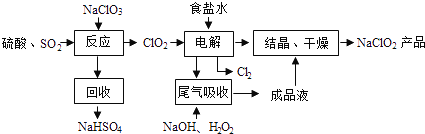
回答下列问题:
(1)NaClO2中Cl的化合价为__________价。
(2)写出“反应”步骤中生成ClO2的化学方程式___________________。
(3)“电解”中阴极反应的主要产物是_________________。
(4)“尾气吸收”是吸收“电解”过程排出的少量ClO2,此吸收反应中,氧化剂与还原剂的物质的量之比为_________, 该反应中氧化产物是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为![]() 。下列说法正确的是
。下列说法正确的是
A. 1L0.1mol·![]() NH4Cl溶液中,
NH4Cl溶液中, ![]() 的数量为0.1
的数量为0.1![]()
B. 2.4gMg与H2SO4完全反应,转移的电子数为0.1![]()
C. 标准状况下,2.24LN2和O2的混合气体中分子数为0.2![]()
D. 0.1mol H2和0.1mol I2于密闭容器中充分反应后,其分子总数为0.2![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组为了制取、收集纯净干燥的氯气并探究氯气的性质,他们设计了如图所示的实验装置:
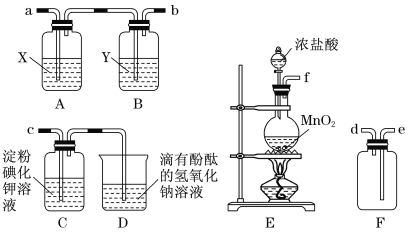
请回答下列问题:
(1)整套实验装置的连接顺序是f接( ) ( )接( )( )接( )(各接口处的字母代号)。_________
(2)E装置中制取氯气的离子方程式是_________________________。
(3)B装置的作用是__________________;A装置中试剂X是________________。
(4)C装置中可观察到的现象是____________。
(5)ClO2和氯气具有相似的性质,用如图装置可以测定某混合气中ClO2 的含量:(其他成分不参与反应)
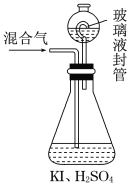
Ⅰ.在锥形瓶中加入足量的碘化钾,用50 mL水溶解后,再加入3 mL稀硫酸;
Ⅱ.在玻璃液封装置中加入水,使液面没过玻璃液封管的管口;
Ⅲ.将一定量的混合气体通入锥形瓶中吸收;
Ⅳ.将玻璃液封装置中的水倒入锥形瓶中;
Ⅴ.用0.100 0 mol·L-1 硫代硫酸钠标准溶液滴定锥形瓶中的溶液(I2+2S2O32-=2I-+S4O62-),指示剂
显示终点时共用去20.00 mL硫代硫酸钠溶液。在此过程中:
A. 锥形瓶内ClO2与碘化钾反应的离子方程式为__________________________________。
B. 测得混合气中ClO2的质量为________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无色气体N2O4是一种强氧化剂,为重要的火箭推进剂之一。N2O4与NO2转换的热化学方程式为N2O4(g)![]() 2NO2(g) ΔH=+24.4 kJ/mol。
2NO2(g) ΔH=+24.4 kJ/mol。
(1)将一定量N2O4投入固定容积的真空容器中,下述现象能说明反应达到平衡的是 _________。
a.v正(N2O4)=2v逆(NO2)
b.体系颜色不变
c.气体平均相对分子质量不变
d.气体密度不变
达到平衡后,保持体积不变升高温度,再次到达平衡时,混合气体颜色____(填 “变深”“变浅”或“不变”),判断理由_______。
(2)平衡常数K可用反应体系中气体物质分压表示,即K表达式中用平衡分压代替平衡浓度,分压=总压×物质的量分数[例如:p(NO2)=p总×x(NO2)]。写出上述反应平衡常数Kp表达式 _______________________(用p总、各气体物质的量分数x表示);影响Kp的因素_________________。
(3)上述反应中,正反应速率v正=k正·p(N2O4),逆反应速率v逆=k逆·p2(NO2),其中k正、k逆为速率常数,则Kp为____(以k正、k逆表示)。若将一定量N2O4投入真空容器中恒温恒压分解(温度298 K、压强100 kPa),已知该条件下k正=4.8×104 s-1,当N2O4分解10%时,v正=______________kPa·s-1。
(4)真空密闭容器中放入一定量N2O4,维持总压强p0恒定,在温度为T时,平衡时N2O4分解百分率为α。保持温度不变,向密闭容器中充入等量N2O4,维持总压强在2p0条件下分解,则N2O4的平衡分解率的表达式为__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com