
【题目】研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g),K1 △H1<0 (Ⅰ)
NaNO3(s)+ClNO(g),K1 △H1<0 (Ⅰ)
2NO(g)+Cl2(g)![]() 2ClNO(g),K2 △H2<0 (Ⅱ)
2ClNO(g),K2 △H2<0 (Ⅱ)
(1)4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示).
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示).
(2)为研究不同条件对反应(Ⅱ)的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应(Ⅱ)达到平衡,测得10min内v(ClNO)=7.5×10﹣3mol·L﹣1·min﹣1,则平衡后n(Cl2)= mol,NO的转化率α1= .其他条件保持不变,反应(Ⅱ)在恒压条件下进行,平衡时NO的转化率α2 α1(填“>”“<”或“=”),平衡常数K2 (填“增大”“减小”“不变”).若要使K2减小,可采取的措是 .
【答案】(1)![]() ;(2)0.025;75%;>;不变;升高温度;
;(2)0.025;75%;>;不变;升高温度;
【解析】
试题(1)已知反应①2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g),K1;反应②2NO(g)+Cl2(g)
NaNO3(s)+ClNO(g),K1;反应②2NO(g)+Cl2(g)![]() 2ClNO(g),K2,则4NO2(g)+2NaCl(s)
2ClNO(g),K2,则4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g)可由2×①—②得到,则K=
2NaNO3(s)+2NO(g)+Cl2(g)可由2×①—②得到,则K=![]() 。
。
(2)2NO(g)+Cl2(g)![]() 2ClNO(g) △H2<0 (Ⅱ)
2ClNO(g) △H2<0 (Ⅱ)
起始浓度(mol/L) 0.1 0.05 0
变化浓度(mol/L)0.075 0.0375 0.075
平衡浓度(mol/L) 0.025 0.0125 0.075
则平衡后n(Cl2)=0.0125mol/L×2L=0.025mol;NO的转化率α1=0.075÷0.1×100%=75%;其他条件保持不变,反应(Ⅱ)在恒压条件下进行,则反应(II)的压强大于反应(I)的压强,平衡更有利于向右移动,所以平衡时NO的转化率а2 >а1;因为温度不变,所以平衡常数不变;反应(II)H < 0,为放热反应,所以升高温度,平衡向左移动,K2减小。


 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象所得出的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 向苯酚浊液中滴加Na2CO3溶液,浊液变清 | 苯酚的酸性强于H2CO3的酸性 |
B | 向碘水中加入等体积CCl4,振荡后静置,上层接近无色,下层显紫红色 | I2在CCl4中的溶解度大于在水中的溶解度 |
C | 向CuSO4溶液中加入铁粉,有红色固体析出 | Fe2+的氧化性强于Cu2+的氧化性 |
D | 向NaCl、NaI的混合稀溶液中滴入少量稀AgNO3溶液,有黄色沉淀生成 | Ksp(AgCl) >Ksp(AgI) |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是_____。
(2)已知0.2molKBrO3在反应中得到1mol电子生成X,则X的化学式为:_____。
(3)根据上述反应可推知_____。
a.氧化性:KBrO3>H3AsO4 b.氧化性:H3AsO4>KBrO3
c.还原性:AsH3>X d.还原性:X>AsH3
(4)根据上述条件写出化学方程式,并用单线桥表示电子转移。__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 淀粉和纤维素在酸催化下完全水解后的产物都是葡萄糖
B. 乙醛和丙烯醛(![]() )不是同系物,它们与氢气充分反应后的产物也不是同系物
)不是同系物,它们与氢气充分反应后的产物也不是同系物
C. 乳酸薄荷醇酯(![]() )仅能发生水解、氧化、消去反应
)仅能发生水解、氧化、消去反应
D. 现代化学分析中,可采用质谱法来确定有机物分子中的官能团
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2016·新课标全国卷Ⅰ) 秸秆(含多糖类物质)的综合应用具有重要的意义。下面是以秸秆为原料合成聚酯类高分子化合物的路线:
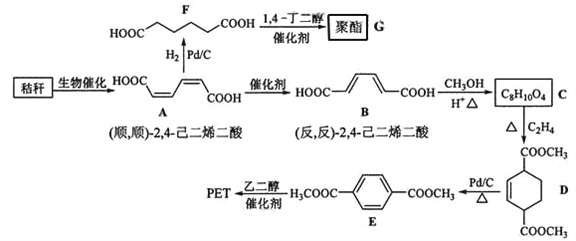
回答下列问题:
(1)下列关于糖类的说法正确的是______________。(填标号)
a.糖类都有甜味,具有CnH2mOm的通式
b.麦芽糖水解生成互为同分异构体的葡萄糖和果糖
c.用银镜反应不能判断淀粉水解是否完全
d.淀粉和纤维素都属于多糖类天然高分子化合物
(2)B生成C的反应类型为______。
(3)D中官能团名称为______,D生成E的反应类型为______。
(4)F 的化学名称是______,由F生成G的化学方程式为______。
(5)具有一种官能团的二取代芳香化合物W是E的同分异构体,0.5 mol W与足量碳酸氢钠溶液反应生成44 g CO2,W共有______种(不含立体结构),其中核磁共振氢谱为三组峰的结构简式为_________。
(6)参照上述合成路线,以(反,反)2,4己二烯和C2H4为原料(无机试剂任选),设计制备对二苯二甲酸的合成路线_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与科学、技术、社会、环境密切相关.下列有关说法中错误的是( )
A. 节日燃放的焰火是某些金属元素焰色反应所呈现出来的色彩
B. 为防止中秋月饼等富脂食品因被氧化而变质,常在包装袋中放入生石灰或硅胶
C. 小苏打是制作馒头和面包等糕点的膨松剂,还是治疗胃酸过多的一种药剂
D. 青铜是我国使用最早的合金材料,目前世界上使用量最大的合金材料是钢铁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于碱金属元素的下列叙述中,错误的是( )
A.碱金属元素原子最外层都只有1个电子
B.随电子层数增加,原子半径增大,金属还原性增强
C.随核电荷数递增,氢氧化物碱性增强
D.Li、Na、K、Rb、Cs,单质熔沸点升高,密度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某新型可充电电池,能长时间保持稳定的放电电压。该电池的总反应式为
3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH,以下说法不正确的是
3Zn(OH)2+2Fe(OH)3+4KOH,以下说法不正确的是
A. 放电时负极反应式为Zn+2OH--2e- = Zn(OH)2
B. 放电时正极反应式为 FeO42-+4H2O+3e-= Fe(OH)3+5OH-
C. 放电时每转移3 mol电子,正极有1mol K2FeO4被氧化
D. 充电时阳极附近溶液的碱性减弱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com